10.000 bis 15.000 Menschen sterben in Deutschland jährlich an Infektionen durch Krankenhauskeime. Wissenschaftler um den Mediziner Professor Becker haben nun ein neues effektives Mittel gegen einen der gefährlichsten Vertreter dieser Keime entwickelt.
Knapp ein Drittel der Bevölkerung trägt es ständig in der Nase: das Bakterium Staphylococcus aureus. „Das stellt zunächst keine Gefahr dar, es müssen erst weitere Faktoren hinzukommen, die es dem Erreger ermöglichen, eine Infektion zu verursachen“, sagt Professor Dr. Karsten Becker vom Universitätsklinikum Münster. Erst wenn die Keime auf einen Menschen treffen, der abwehrgeschwächt ist oder dessen schützende Hautbarriere etwa durch eine Operation durchbrochen wurde, wird es gefährlich. Es kann zu lebensbedrohlichen Infektionen wie schweren Wundinfektionen, Blutvergiftungen und Lungenentzündungen kommen. Diese werden in der Regel mit Antibiotika behandelt. Doch der MRSA-Erreger, eine Variante des Bakteriums, die etwa 15 bis 20 Prozent aller Staphylococcus aureus im Krankenhaus ausmacht, ist resistent gegen die wirksamsten Antibiotika. Allein dieser Krankenhauskeim ist in Deutschland verantwortlich für etwa 14.000 Krankenhausinfektionen im Jahr.

Schätzungen zufolge sterben jedes Jahr 10.000 bis 15.000 Menschen in Deutschland an Infektionen durch Krankenhauskeime.
Thinkstock - chromatika
Virenprotein tötet Krankenhauskeime innerhalb kürzester Zeit
Knapp ein Drittel der Bevölkerung trägt das Bakterium Staphylococcus aureus in der Nase.
shutterstock: schankz
Alternativen zu den herkömmlichen Antibiotikatherapien sind daher dringend notwendig. Nach den Empfehlungen des Robert-Koch-Institutes werden Risikopatienten bei der Einweisung ins Krankenhaus auf MRSA getestet. Nach dem herkömmlichen Verfahren werden sie bei positivem Befund isoliert und mehrere Tage lang mit einem speziellen Antibiotikum behandelt, gegen das die Bakterien noch keine Resistenzen ausgebildet haben. Ein Team aus Forschern der Universitäten Münster und Tübingen setzt dagegen auf eine unkonventionelle Prophylaxe- Methode bei der ihnen ein Virus zur Hilfe kommt. Dieses als Bakteriophage (griechisch: „bakterienfressend“) bezeichnete Virus produziert ein Protein, das speziell Staphylococcus aureus angreift. „Der neue Wirkstoff tötet die Bakterien in wenigen Minuten ab“, erklärt Becker. Ein weiterer Vorteil ist, dass das Virusprotein ausschließlich den gefährlichen Keim angreift. Die natürliche Mikroflora in der Nase mit ihren 200 Spezies bleibt dabei im Gegensatz zu einer Antibiotikatherapie verschont.
Die schnelle Wirkweise entlastet nicht nur den Patienten, sondern beugt auch einer weiteren Resistenzbildung der Bakterien vor. „Das designte Molekül dockt an die Oberfläche des Staphylococcus aureus an und schneidet die Zellwand auf. In dem Bakterium herrscht im Vergleich zur Umgebung ein starker Überdruck, sodass bereits ein kleines Loch sie wie einen Luftballon zum Platzen bringt. Somit sterben die Bakterien, noch bevor sie Resistenzen ausbilden können“, erklärt Dr. Wolfgang Mutter von der Hyglos GmbH. Seine Firma hat den Wirkstoff für dieses Forschungsprojekt entwickelt, das im Rahmen des Förderschwerpunkts „Medizinische Infektionsgenomik“ vom Bundesministerium für Bildung und Forschung (BMBF) gefördert wurde.
Blick zurück liefert neue Ansätze gegen multiresistente Erreger
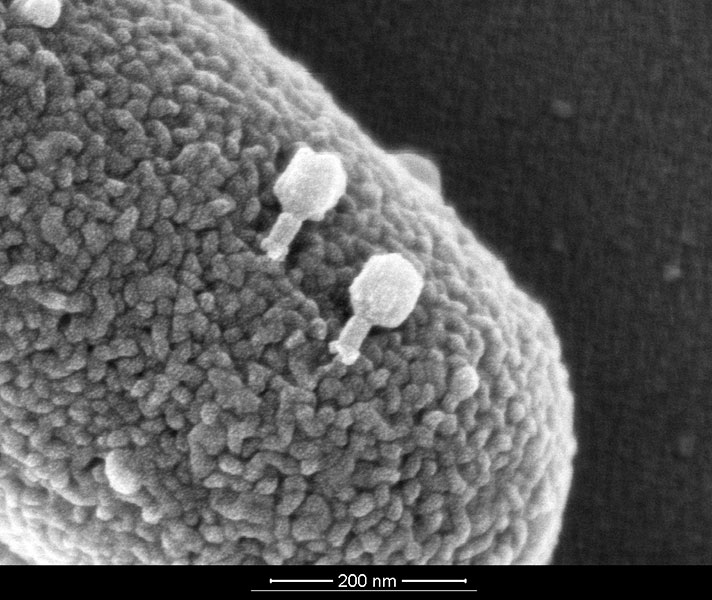
Elektronenmikroskopische Aufnahme von T4Bakteriophagen auf der Oberfläche eines Escherichia-coli- Bakteriums.
Hyglos GmbH, Bernried
Die Idee, Viren gegen Bakterien einzusetzen, ist nicht neu. Bereits vor der Entdeckung des Penicillins kamen Bakteriophagen zum Einsatz, vor allem in der ehemaligen Sowjetunion. Bakteriophagen sind Viren, die auf Bakterien als Wirtszellen spezialisiert sind. Allerdings sind diese Therapien in westlichen Ländern nie großflächig zum Einsatz gekommen, da sie auch einige Risiken für den Patienten bergen. Bateriophagen können Bakterien etwa zur Produktion von Giftstoffen anregen. Auch fehlen bisher nach heutigen wissenschaftlichen Standards kontrolliert durchgeführte Studien. Angesichts des Kampfs gegen die wachsende Bedrohung durch multiresistente Erreger wird diese Behandlungsmethode wieder interessant. Das Forscherteam um Becker nutzt lediglich ein spezielles Protein des Phagen, das nach den bisherigen Erkenntnissen keine Nebenwirkungen hat und somit ungefährlich ist.
Vision: Nasenspray gegen MRSA-Keime
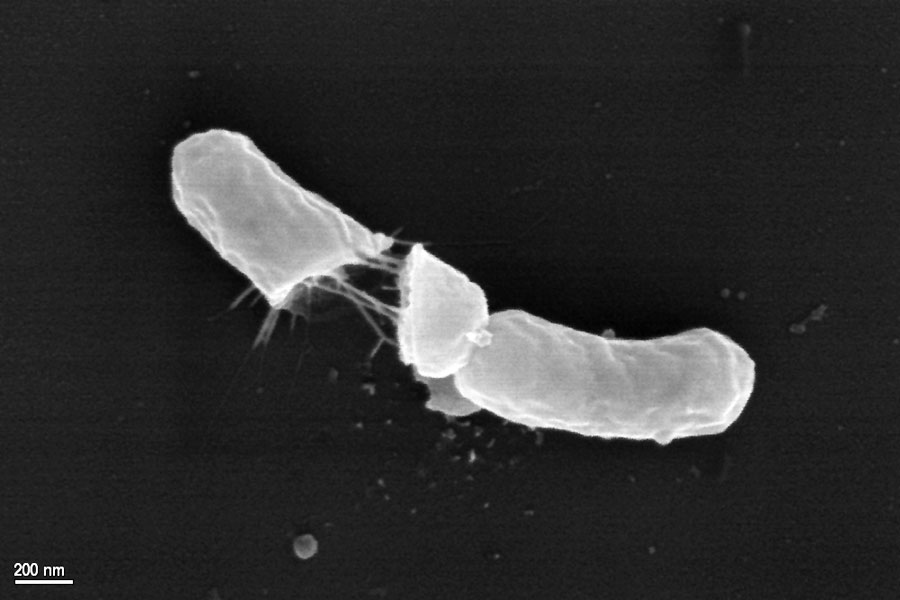
Elektronenmikroskopische Aufnahme einer geplatzten Bakterienzelle nach zweiminütiger Einwirkzeit des Wirkstoffs.
Hyglos GmbH, Bernried
Im nächsten Schritt soll der Wirkstoff in Zusammenarbeit mit Wissenschaftlern vom Deutschen Zentrum für Infektionsforschung (DZIF) für die klinische Prüfung vorbereitet werden. Dafür stellt das DZIF mehr als 1,5 Millionen Euro bereit. Die Forscher hoffen, dass der fertige Wirkstoff bereits in 15 Monaten auf den Markt kommt. Ihre Vision: Der Patient wird bei Ankunft in der Klinik mit einem Nasenspray oder einer Salbe behandelt und kann anschließend ohne die Gefahr einer MRSA-Infektion für sich oder einer Übertragung auf andere Patienten auf eine normale Station verlegt werden.
Mit der Entschlüsselung des menschlichen Genoms im Jahr 2000 wurde ein neues Zeitalter in der biologischen und medizinischen Forschung eingeläutet. Dank der Entwicklung neuartiger Technologien ist es seitdem möglich, die wesentlichen in Lebewesen vorkommenden Moleküle in einem Anlauf und mit beispielloser Spannweite zu untersuchen. Bereits im Jahr 2001 hat das Bundesministerium für Bildung und Forschung (BMBF) damit angefangen, den Einsatz solcher innovativen Methoden im Bereich der Infektionsforschung zu unterstützen. Im Rahmen nationaler und internationaler Forschungsmaßnahmen wie etwa der „Medizinischen Infektionsgenomik“ und dem „ERA-NET PathoGenoMics“ wurde unter anderem das Erbgut von menschlichen Krankheitserregern entschlüsselt. Auf dieser Wissensbasis bauen weitere Fördermaßnahmen auf, mit dem Ziel, die gewonnenen Erkenntnisse zu vertiefen und zum Wohle des Menschen in Klinik und Wirtschaft zu überführen. Mit der internationalen Fördermaßnahme „Infect-ERA“, an dem das BMBF beteiligt ist, wird seit 2012 ein breites Spektrum von Forschungsthemen zu menschlichen Infektionskrankheiten unterstützt. Gemeinsames Ziel ist es, durch ein erweitertes Verständnis von Krankheitserregern und deren Wechselwirkung mit dem Wirt verbesserte Ansätze der Prävention, Diagnose und Behandlung von Infektionskrankheiten zu ermöglichen. Das BMBF fördert zudem Forschungsverbünde zu Krankheitserregern und Antibiotika-Resistenzen, die von Tieren auf Menschen übertragbar sind. Mehr dazu lesen Sie ab Seite 26. Da die stetig voranschreitende Entstehung von multiresistenten Erregern weltweit eine besondere Herausforderung für die Gesundheit darstellt, beteiligt sich das BMBF speziell zu dieser Problematik an einer internationalen Zusammenarbeit. Seit 2012 bündelt die „Joint Programming initiative on Antimicrobial Resistance (JPIAMR)“ die Anstrengungen Deutschlands mit 18 anderen Ländern, um umfassende und kreative Ansätze gegen diese Bedrohung zu entwickeln.
Ansprechpartner:
Prof. Dr. Karsten Becker
Universitätsklinikum Münster
Institut für Medizinische Mikrobiologie
Domagkstraße 10
48149 Münster
0251 83-55375
0251 83-55350
kbecker@uni-muenster.de
Dr. Wolfgang Mutter, MBA
Hyglos GmbH
Am Neuland 3
82347 Bernried
08158 9060-201
08158 9060-210
Wolfgang.Mutter@hyglos.de