Für das Akute Atemnot-Syndrom gibt es bislang keine Therapie. Das Deutsche Zentrum für Lungenforschung untersucht in einer klinischen Studie die Wirksamkeit des Wachstumsfaktors GM-CSF als inhalatives Medikament – auch bei COVID-19-Erkrankten.

Akute Infektionen der unteren Atemwege stellen ein weltweit steigendes Gesundheitsproblem dar und führen mit ihrer seit 50 Jahren unveränderten Sterblichkeitsrate zu einer größeren Belastung als jede andere Infektion. Für den schweren Verlauf einer solchen Infektion, das Akute Atemnot-Syndrom (Acute Respiratory Distress Syndrome oder kurz ARDS) gibt es bis heute keine Therapie.
Professorin Dr. Susanne Herold, Abteilungsleiterin des Schwerpunkts Infektiologie am Universitätsklinikum in Gießen, startete 2017 die randomisierte, doppelblinde klinische Studie GI-HOPE (GM-CSF Inhalation to improve HOst defense and Pulmonary barrier rEstoration), die die Wirksamkeit des Wachstumsfaktors GM-CSF bei ARDS belegen soll. Durchgeführt wird die vom Bundesministerium für Bildung und Forschung (BMBF) und den Sitzländern des DZL anteilig geförderte Studie an insgesamt sechs Standorten in Deutschland. Ab sofort werden auch Patientinnen und Patienten mit COVID-19-assoziiertem ARDS in die Studie eingeschlossen.

Erkrankte mit ARDS leiden unter extremer Luftnot. Sie müssen künstlich beatmet werden.
baytunc/iStock
Atemnot als Folge anderer Grunderkrankungen
ARDS kennzeichnet sich durch akut einsetzende, schwere Luftnot. Dem Syndrom geht immer eine Schädigung der Lunge voraus, die sowohl durch direkte, mikrobielle Angriffe von Bakterien oder Viren als auch durch indirekte, entzündliche Verletzungen wie beispielsweise Aspiration, Trauma oder Sepsis ausgelöst werden kann. Zu den häufigsten Ursachen des ARDS zählt unter anderem die bakterielle Pneumonie – eine oftmals durch Pneumokokken ausgelöste Lungenentzündung. Sie führt zu einer massiven Ausschüttung von Entzündungsmediatoren und einer Schädigung der Lungenbläschen, den sogenannten Alveolen. Ihre Wand wird durchlässiger, es gelangt mehr Flüssigkeit von den Blutgefäßen in die Lungenbläschen, und es kommt zu einem Lungenödem. Im weiteren Verlauf vermehrt sich aufgrund der Entzündung das Bindegewebe in der Lunge. Das beeinträchtigt wiederum den Gasaustausch an den Lungenbläschen, sodass der Körper immer schlechter mit Sauerstoff versorgt wird. Gleichzeitig kann es auch zum Abbau von Surfactant, einem von der Lunge produzierten, schützenden Oberflächenfilm auf den Lungenbläschen, kommen und damit zum Kollaps der Lungenbläschen.
Bisher keine Therapiemöglichkeiten für ARDS
Da es trotz intensiver Forschung noch keine Medikamente zur Behandlung des ARDS gibt, ist der therapeutische Ansatz die Behandlung des Auslösers, also der vorangegangenen Grunderkrankung. ARDS-Patienten müssen künstlich beatmet werden, um die Sauerstoffversorgung sicherzustellen. In einzelnen Fällen kann auch eine künstliche Lunge eingesetzt werden, bei der dem Blut der Patientinnen und Patienten außerhalb des Körpers Sauerstoff zugeführt und Kohlendioxid entzogen wird.
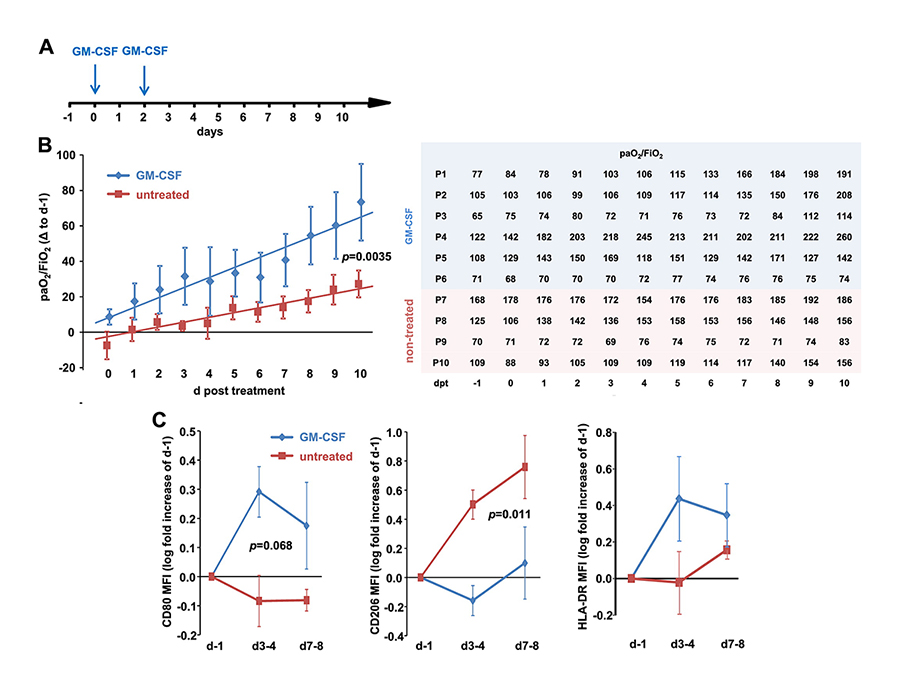
Messungen der Sauerstoffversorgung (paO2/FIO2) zeigen, dass Patientinnen und Patienten nach zweimaliger GM-CSF-Gabe (blaue Linie) eine bessere Sauerstoffversorgung haben als Erkrankte ohne GM-CSF-Behandlung (rote Linie). Gemessen wurde an zehn aufeinanderfolgenden Tagen (d post treatment).
AM J Respir Crit Care Med, 2014 Mar 1;189(5):609-11
Wachstumsfaktor GM-CSF zeigt Wirkung
Herold untersuchte schon in verschiedenen Zellkultur- und Tiermodellen sowie in klinischen Modellen die Wirksamkeit des sogenannten Wachstumsfaktors GM-CSF. Bei GM-CSF handelt es sich um einen Zellwachstums- und Differenzierungsfaktor, der im Blut zirkuliert und Immunzellen aktivieren, differenzieren und in Bewegung setzen soll, um die Infektion zu bekämpfen. Das GM-CSF wirkt aber auch stark regenerativ auf das Lungengewebe. Es führt zum Rücktransport von Flüssigkeitsansammlungen aus den Lungenbläschen und stärkt die Barrierefunktion. Die durch die Infektion gestörte Funktion der Alveolen kann so wiederhergestellt werden.
Deutsches Zentrum für Lungenforschung (DZL e. V.)
Das Deutsche Zentrum für Lungenforschung (DZL e. V.) ist ein vom Bundesministerium für Bildung und Forschung (BMBF) gemeinsam mit fünf Sitzländern geförderter Zusammenschluss aus 29 führenden universitären und außeruniversitären Einrichtungen, die sich der Erforschung von Atemwegserkrankungen widmen. Im DZL wird die grundlagen-, krankheits- und patientenorientierte Forschung auf dem Gebiet der Lungenerkrankungen koordiniert und auf internationalem Spitzenniveau durchgeführt, um so die Translation grundlagenwissenschaftlicher Erkenntnisse in neue klinische Konzepte zur Verbesserung der Patientenversorgung zu beschleunigen.
Mehr Informationen unter: www.dzl.de
Originalpublikation:
Herold S, Hoegner K, Vadász I, et al. Inhaled granulocyte/macrophage colony-stimulating factor as treatment of pneumonia-associated acute respiratory distress syndrome. Am J Respir Crit Care Med. 2014 Mar 1; 189(5):609-11. doi: 10.1164/rccm.201311-2041LE.
Fachliche Ansprechpartnerin:
Prof. Dr. Susanne Herold, PhD
Universitätsklinikum Gießen
Professur für Infektionskrankheiten der Lunge
Susanne.Herold@innere.med.uni-giessen.de
Pressekontakt:
Alina Zidaric
Deutsches Zentrum für Lungenforschung (DZL)
Geschäftsstelle/Presse- und Öffentlichkeitsarbeit
Aulweg 130
35392 Gießen