Erstmals ist es Wissenschaftlern gelungen, eine neue Röntgenlaser-Methode zur Entschlüsselung der molekularen Struktur von Proteinen einzusetzen. Ihr erstes Ziel war ein wichtiges Protein aus dem Parasiten Trypanosoma brucei, dem Auslöser der Schlafkrankheit. Durch die Aufklärung des Bauplans könnte zukünftig ein perfekter Hemmstoff dieses Proteins als Mittel gegen die Infektionskrankheit entwickelt werden. (Newsletter 63 / August 2013)
 Die Tsetse-Fliege, Überträger des Parasiten Trypanosoma brucei.Warum ist es wichtig, die Struktur eines Proteins genau zu kennen? Für Dr. Lars Redecke, Leiter der Nachwuchsgruppe „Strukturelle Infektionsbiologie unter Anwendung neuer Strahlungsquellen“, kurz SIAS, ist die Antwort eindeutig: „Nur wer die Struktur eines Proteins bis ins Detail kennt, kann auch seine Funktion verstehen und im nächsten Schritt – nach dem Schlüssel-Schloss-Prinzip – einen Hemmstoff gegen das Protein entwickeln.“ Letzteres ist von besonderem Interesse, wenn es sich um ein Protein handelt, dass bei der Entstehung einer Krankheit eine Rolle spielt. Wie im Falle des Proteins Cathepsin B, das die Nachwuchswissenschaftlerinnen und Nachwuchswissenschaftler der Universitäten Hamburg und Lübeck kürzlich genau unter die Lupe oder besser unter den Laser genommen haben. Cathepsin B ist ein Enzym des Parasiten Trypanosoma brucei, Auslöser der Schlafkrankheit, genauer eine Protease, die nach der Infektion Proteine des Menschen zerschneidet und diese dem Parasiten zuführt. „Das Enzym hat sich in früheren Untersuchungen als vielversprechender Ansatzpunkt für ein Medikament gegen die Schlafkrankheit erwiesen“, erläutert Dr. Redecke. Versuche haben gezeigt, dass die Entfernung des Gens für dieses Protein den Parasiten lebensunfähig macht. „Bei Mäusen konnte so eine Infektion mit Trypanosomen geheilt werden“, sagt Dr. Redecke. Da das Enzym bei allen Säugetieren und damit auch beim Menschen vorkommt, ist es wichtig, dass ein Hemmstoff ganz gezielt und hochspezifisch das Protein des Parasiten, nicht aber das ähnliche Protein des Menschen blockiert. „Deshalb müssen wir die Struktur ganz exakt kennen“, betont Dr. Redecke, der am DESY in Hamburg in einer gemeinsamen Außenstelle der Universitäten Hamburg und Lübeck die Struktur von Proteinen erforscht.
Die Tsetse-Fliege, Überträger des Parasiten Trypanosoma brucei.Warum ist es wichtig, die Struktur eines Proteins genau zu kennen? Für Dr. Lars Redecke, Leiter der Nachwuchsgruppe „Strukturelle Infektionsbiologie unter Anwendung neuer Strahlungsquellen“, kurz SIAS, ist die Antwort eindeutig: „Nur wer die Struktur eines Proteins bis ins Detail kennt, kann auch seine Funktion verstehen und im nächsten Schritt – nach dem Schlüssel-Schloss-Prinzip – einen Hemmstoff gegen das Protein entwickeln.“ Letzteres ist von besonderem Interesse, wenn es sich um ein Protein handelt, dass bei der Entstehung einer Krankheit eine Rolle spielt. Wie im Falle des Proteins Cathepsin B, das die Nachwuchswissenschaftlerinnen und Nachwuchswissenschaftler der Universitäten Hamburg und Lübeck kürzlich genau unter die Lupe oder besser unter den Laser genommen haben. Cathepsin B ist ein Enzym des Parasiten Trypanosoma brucei, Auslöser der Schlafkrankheit, genauer eine Protease, die nach der Infektion Proteine des Menschen zerschneidet und diese dem Parasiten zuführt. „Das Enzym hat sich in früheren Untersuchungen als vielversprechender Ansatzpunkt für ein Medikament gegen die Schlafkrankheit erwiesen“, erläutert Dr. Redecke. Versuche haben gezeigt, dass die Entfernung des Gens für dieses Protein den Parasiten lebensunfähig macht. „Bei Mäusen konnte so eine Infektion mit Trypanosomen geheilt werden“, sagt Dr. Redecke. Da das Enzym bei allen Säugetieren und damit auch beim Menschen vorkommt, ist es wichtig, dass ein Hemmstoff ganz gezielt und hochspezifisch das Protein des Parasiten, nicht aber das ähnliche Protein des Menschen blockiert. „Deshalb müssen wir die Struktur ganz exakt kennen“, betont Dr. Redecke, der am DESY in Hamburg in einer gemeinsamen Außenstelle der Universitäten Hamburg und Lübeck die Struktur von Proteinen erforscht.
Auf der Suche nach einem maßgeschneiderten Hemmstoff
Mit einer neuen Lasertechnik haben die Forscher in einer internationalen Kooperation charakteristische Unterschiede in der molekularen Struktur des Enzyms zwischen Mensch und Parasit gefunden. „Bei unserer Untersuchung war in der aktiven Tasche des Proteins ein natürlicher Hemmstoff des Enzyms, das sogenannte Propeptid, gebunden. Dieses Propeptid blockiert im Parasiten Cathepsin B so lange, bis es seinen Wirkungsort erreicht hat“, beschreibt der Experte. Durch die Analyse der Bindung wurden wichtige Informationen darüber erhalten, wie der Parasit selbst das Enzym blockiert, die nun für die Entwicklung neuer Hemmstoffe oder die Optimierung bereits existierender genutzt werden können. Derzeit verfügbare Hemmstoffe können nicht ausreichend zwischen dem parasitären und humanen Enzym unterscheiden und scheiden somit als Wirkstoffe aus. „Unsere Ergebnisse liefern bislang fehlende Details, die nun zu einem maßgeschneiderten Hemmstoff führen könnten.“ Ein mögliches neues Medikament ist allerdings noch weit entfernt.
Kristalle im Laserstrahl
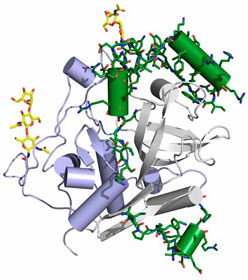 Vereinfachte Darstellung der molekularen Struktur von Cathepsin B. Der natürliche Hemmstoff, das Propeptid, ist grün dargestellt.Um die Struktur von Cathepsin B zu entschlüsseln, mussten die Wissenschaftlerinnen und Wissenschaftler das Protein zunächst kristallisieren. Bislang waren für eine Strukturanalyse relativ große Kristalle mit einem Durchmesser von etwa 100 bis 200 μm nötig, also einem Zehntel bis Fünftel Millimeter. „Diese herzustellen war – je nach Protein – manchmal unmöglich“, sagt Dr. Redecke. Deshalb haben die Wissenschaftlerinnen und Wissenschaftler mit Unterstützung des Bundesministeriums für Bildung und Forschung (BMBF) erstmals eine neue Methode zur Aufklärung einer Proteinstruktur angewendet, die Serielle Femtosekunden-Röntgenkristallografie. Der Vorteil der Methode: Sehr viel kleinere Proteinkristalle, mit einer Kantenlänge im Nanometer- oder sehr geringen Mikrometerbereich, reichen aus, um ein exaktes dreidimensionales Strukturmodell von Proteinen zu erhalten.
Vereinfachte Darstellung der molekularen Struktur von Cathepsin B. Der natürliche Hemmstoff, das Propeptid, ist grün dargestellt.Um die Struktur von Cathepsin B zu entschlüsseln, mussten die Wissenschaftlerinnen und Wissenschaftler das Protein zunächst kristallisieren. Bislang waren für eine Strukturanalyse relativ große Kristalle mit einem Durchmesser von etwa 100 bis 200 μm nötig, also einem Zehntel bis Fünftel Millimeter. „Diese herzustellen war – je nach Protein – manchmal unmöglich“, sagt Dr. Redecke. Deshalb haben die Wissenschaftlerinnen und Wissenschaftler mit Unterstützung des Bundesministeriums für Bildung und Forschung (BMBF) erstmals eine neue Methode zur Aufklärung einer Proteinstruktur angewendet, die Serielle Femtosekunden-Röntgenkristallografie. Der Vorteil der Methode: Sehr viel kleinere Proteinkristalle, mit einer Kantenlänge im Nanometer- oder sehr geringen Mikrometerbereich, reichen aus, um ein exaktes dreidimensionales Strukturmodell von Proteinen zu erhalten.
Hierzu wird ein neuer hochenergetischer Laser genutzt, der in sehr kurzen zeitlichen Intervallen seine energiereichen Strahlen aussenden kann – im Abstand von wenigen Femtosekunden. „Eine Femtosekunde ist so kurz, dass wir es uns gar nicht vorstellen können“, sagt der Chemiker. „Sie entspricht dem Billiardstel einer Sekunde!“ Sehr viele der kleinen Kristalle werden in den Laserstrahl eingespitzt. Trifft ein Laserpuls einen Kristall, werden die Strahlen an den Atomen des Proteins abgelenkt, genauer gebeugt. Das erzeugte Beugungsbild wird anschließend am Computer ausgewertet. „Eine weitere Innovation ist, dass wir mit dieser Lasertechnik erstmals Kristalle strukturell untersuchen konnten, die nicht aufwendig im Reagenzglas gezüchtet wurden, sondern spontan in lebenden Zellen gewachsen sind, sogenannte Invivo-Kristalle“, beschreibt Dr. Redecke. „Das war bislang nicht möglich.“ Die neue Methodik wurde vom Fachmagazin „Science“ als einer der zehn wichtigsten wissenschaftlichen Durchbrüche des Jahres 2012 eingestuft.