Eine Jenaer Forschungsgruppe entwickelt „Mini-Organe“, die auf einem Biochip wachsen. Anhand dieser untersuchen die Forscherinnen und Forscher, wie eine Blutvergiftung entsteht und welche Folgen sie für den menschlichen Körper hat.
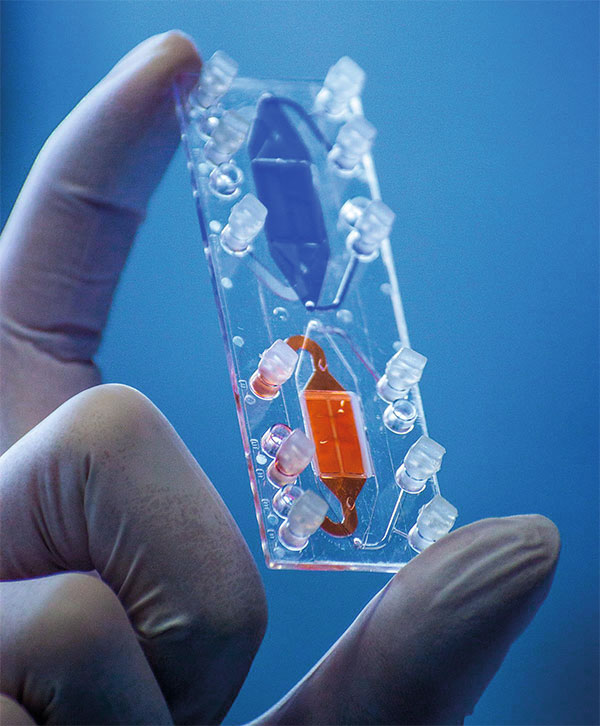
So klein wie eine Fingerkuppe: Auf diesem Plastik-Träger können zwei Mini-Organe miteinander verbunden werden.
Martin Raasch (CSCC)
Die Sepsis – auch Blutvergiftung genannt – ist eine lebensbedrohliche Erkrankung. Ursache ist oft nur ein kleiner lokaler Entzündungsherd – sei es eine Schnittwunde oder ein harmloser Harnwegsinfekt –, der sich binnen kurzer Zeit im gesamten Organismus ausbreitet. Eine wesentliche Rolle spielt dabei die natürliche Barrierefunktion der Schleimhäute und Gefäßwände. Ist sie defekt, können nicht nur Bakterien in sonst geschützte Bereiche vordringen, auch Durchblutung und Gerinnung sind dadurch im Verlauf einer akuten Sepsis massiv beeinträchtigt. In der Folge werden die Organe nicht mehr ausreichend versorgt und versagen ihren Dienst.
In der Sepsisforschung wird deshalb untersucht, wie es zu diesem Verlust der Schutzfunktion kommen kann. Erstmalig kann dieses Szenario nun an sogenannten Mini-Organen erforscht werden. Eine Nachwuchsgruppe am Center for Sepsis Control and Care (CSCC) in Jena hat dafür menschliche Darm- und Leberzellen zu kleinen organähnlichen Strukturen auf einem Biochip wachsen lassen. Sie ähneln in Funktion und Aufbau ihren großen Vorbildern, den Organen. „Diese Gewebemodelle bilden ähnliche Strukturen und Barrieren und zeigen spezifische Immunreaktionen gegenüber bakteriellen Entzündungsmediatoren“, sagt Dr. Alexander Mosig. Er leitet die Nachwuchsgruppe INSPIRE am CSCC.
Sepsis
Sepsis, in der Bevölkerung besser als Blutvergiftung bekannt, ist eine häufige und bisweilen lebensbedrohliche Krankheit. Auslöser für eine Sepsis ist eine außer Kontrolle geratene Infektion meist durch Bakterien. Bei einer schweren Sepsis kann es zu einem lebensbedrohlichen Organversagen kommen. Noch stirbt jeder Dritte, der an schwerer Sepsis erkrankt ist. Die Überlebenden leiden oft ein Leben lang an den Folgen. Das Bundesforschungsministerium unterstützt deshalb Projekte und Initiativen, die Sepsis und deren Folgen erforschen.
Mithilfe dieser Biochips können nun die Wechselwirkungen zwischen Darm und Leber unter entzündlichen Bedingungen wie bei der Sepsis untersucht werden. Von besonderem Interesse sind dabei die Eiweiße, die den Zusammenhalt von Gefäß- und Darmwandzellen regulieren und somit wesentlich für die Barrierefunktion dieser Zellschichten sind.
Biochip als Alternative zum Tierversuch
Bislang wurden diese Prozesse in Tiermodellen erforscht. „Durch den Einsatz der Biochip-Organ-Systeme konnten bereits zahlreiche Tierversuche eingespart werden“, sagt Mosig. Da die Organmodelle zudem menschliches Gewebe nachbilden, besteht auch die Hoffnung, dass sich die Ergebnisse besser auf den Menschen und damit schneller in die klinische Praxis übertragen lassen. Die Organmodelle werden derzeit als Alternative zum Tierversuch genutzt. Mosig und sein Team unterstützen die Forscherinnen und Forscher des CSCC aktiv bei der Planung ihrer Projekte. Das Ziel ist es, durch optimale Studiendesigns die zugrunde liegenden wissenschaftlichen Fragestellungen besser untersuchen und dadurch neue Behandlungsstrategien für Sepsis entwickeln zu können. „Wenn die Ursachen für die Störungen in der Schutzhülle bekannt sind, eröffnet das neue Möglichkeiten bei der Behandlung akuter Sepsis“, sagt Mosig.
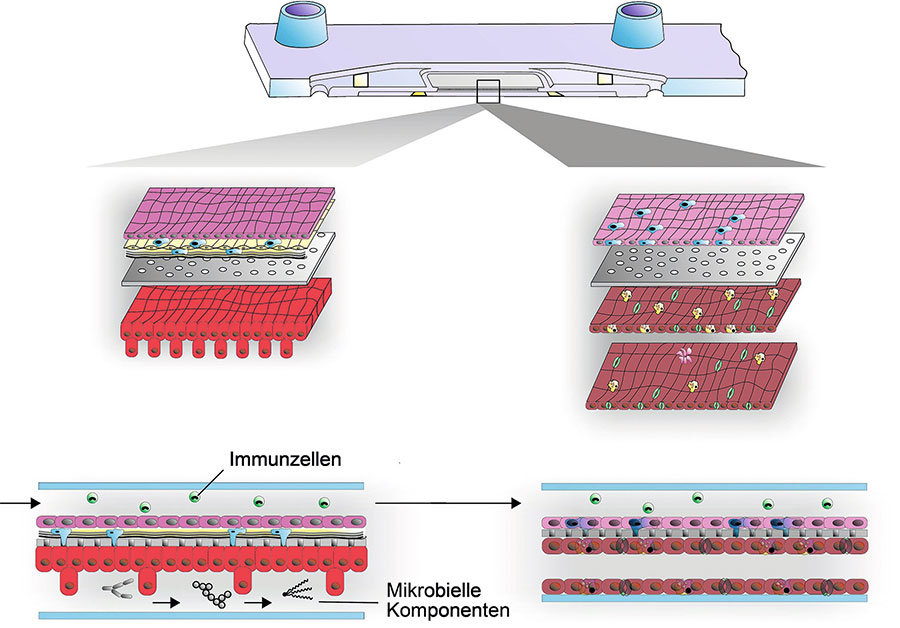
Schematische Darstellung der Organmodelle des Darms (links) und der Leber (rechts). In das Darmmodell können bakterielle Komponenten zur Nachbildung von Komponenten des Mikrobioms integriert werden (unten). Beide Organmodelle sollen durch Blutfluss und die zirkulierenden Immunzellen miteinander in einer künstlichen Darm-Leber-Achse kombiniert werden.
Alexander Mosig (CSCC)
Nach Darm und Leber sollen zukünftig weitere Organe auf dem Chip abgebildet werden: Lunge, Niere und Knochen. Entsprechende Gewebemodelle werden bereits entwickelt. Sie sollen auch durch gefäßähnliche Strukturen miteinander verbunden werden, um Wechselwirkungen zwischen den Organen im gesunden Zustand und bei Sepsis simulieren zu können. Induzierte pluripotente Stammzellen, also in jedem Körper natürlich vorkommende Zellen, die sich in fast allen Organen entwickeln können, würden außerdem Organmodelle ermöglichen, an denen Wirkstoffe individualisiert für Erkrankte getestet werden könnten.
Das Center for Sepsis Control & Care
Das Center for Sepsis Control & Care, kurz CSCC, ist eines von acht integrierten Forschungs- und Behandlungszentren (IFB), die vom Bundesministerium für Bildung und Forschung (BMBF) gefördert werden. Das CSCC ist am Universitätsklinikum Jena angesiedelt und widmet sich der Erforschung von Sepsis und deren Folgeerkrankungen.
Dem CSCC ist es seit seinem Projektbeginn im Jahr 2010 gelungen, die hochqualitative klinische Forschung auf- und auszubauen. Ein wesentliches Ziel des CSCC ist die Förderung des wissenschaftlichen Nachwuchses, insbesondere im klinischen Bereich. Junge Forscherinnen und Forscher werden unter anderem durch Stipendien, Mentoringprogramme und ein strukturiertes Graduiertenprogramm unterstützt.
Ansprechpartner:
PD Dr. Alexander Mosig
Integriertes Forschungs- und Behandlungszentrum für Sepsis und Sepsisfolgen
Nachwuchsgruppe INSPIRE
Am Klinikum 1
07747 Jena
03641 9-390910
03641 9-390919
alexander.mosig@med.uni-jena.de