Forschende des Deutschen Konsortiums für Translationale Krebsforschung (DKTK) züchten im Labor aus individuellen Tumor-Zellen realitätsnahe 3-D-Tumor-Modelle. Die winzigen Gebilde sollen mögliche Angriffsstellen für die Therapie aufzeigen.

Am Boden einer Plastikschale, eingebettet in eine gelartige Substanz und umspült von einer pinkfarbenen Flüssigkeit, befinden sich mikroskopisch kleine Gebilde aus Zellen. Bei den nur wenige Zehntelmillimeter großen Kügelchen handelt es sich um eines der wichtigsten Werkzeuge im Labor von Dr. Henner Farin, Nachwuchsgruppenleiter im Deutschen Konsortium für Translationale Krebsforschung (DKTK) am DKTK-Partnerstandort Frankfurt/Mainz am Georg-Speyer-Haus in Frankfurt. Denn die Zellen haben sich nicht zufällig zusammengelagert: Vielmehr züchtet die von Farin geleitete DKTK-Nachwuchsgruppe „Tumor Mikroumgebung“ winzige Miniaturdärme. Expertinnen und Experten sprechen bei solchen dreidimensionalen Zellkulturen von Organoiden. In Farins Labor sind das kleine Hohlkörper aus Zellen, die sich ähnlich einem echten Darm organartig zusammengefügt haben und auch entscheidende Funktionen des Verdauungsorgans besitzen. Farin nutzt die Minidärme, um mehr über Darmkrebs zu lernen und darüber, mit welchen Wirkstoffen sich dieser möglicherweise bekämpfen lässt.
Um Krebserkrankungen zielgerichtet behandeln zu können, müssen Ärztinnen und Ärzte den Tumor möglichst genau kennen. Das ist aber nicht immer einfach. Denn gerade bei Darmkrebs existieren große genetische Unterschiede zwischen den Tumoren einzelner Patientinnen und Patienten. Entsprechend kann Darmkrebs höchst vielfältige Eigenschaften aufweisen. Dazu zählt auch, wie sich der Tumor am besten therapeutisch angreifen lässt oder ob Resistenzen gegenüber bestimmten Therapien zu befürchten sind.
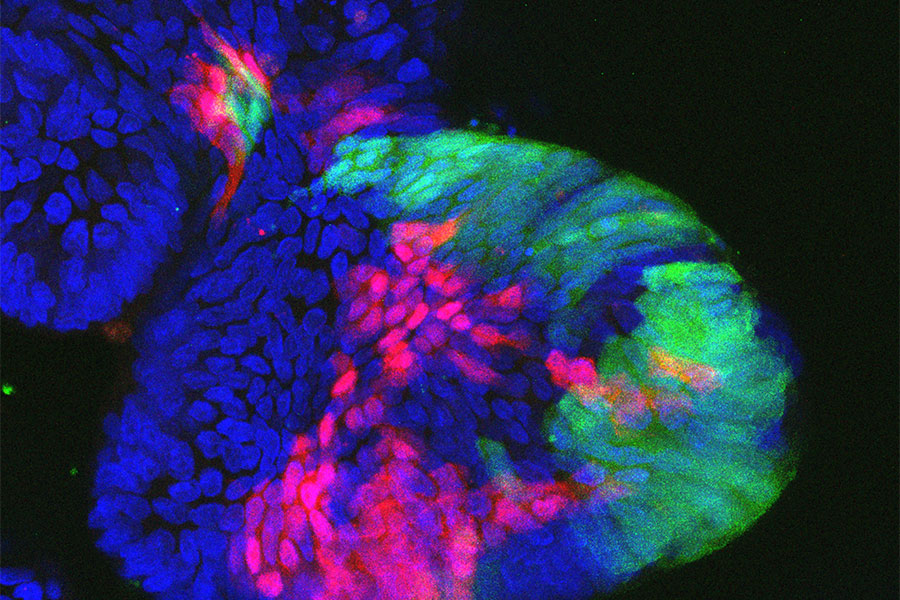
Konfokales Mikroskopiebild von Zellen in humanen DarmOrganoiden: Nach lentiviraler Markierung (grün oder rot fluoreszierendes Protein) können einzelne Zellklone verfolgt werden. Der blaue Farbstoff markiert alle Zellkerne. Das Einbringen von Genscheren (CRISPR/Cas9) erlaubt dann die Untersuchung von Tumor-Suppressorgenen.
Henner Farin/DKTK
Dem echten Tumor sehr ähnlich
Um dies herauszufinden, haben Medizinerinnen und Mediziner dazu bislang Krebszellen ihrer Patientinnen und Patienten gewonnen, in Zellkulturschalen vermehrt und sie dann genauer untersucht. Das hat jedoch einen Nachteil: „Bei diesem Vorgehen erhält man Zelllinien, die mit dem Original-Tumor nicht mehr viel gemeinsam haben“, erklärt Farin. Es liegt auf der Hand, dass sich auf dieser Grundlage nur schwer Aussagen über die Eigenschaften eines Tumors treffen lassen. Diese Problematik umgeht Farin mit der Organoid-Technologie.
Der Frankfurter Wissenschaftler steht mit diesem Forschungsansatz nicht alleine. Gemeinsam mit Dr. Daniel Stange vom Universitätsklinikum Dresden, DKTK-Partnerstandort Dresden, leitet er die Arbeitsgruppe „Präklinische Organoid-Modelle“ im DKTK. Forschende an allen DKTK-Standorten züchten Organoide aus dem individuellen Tumor-Material, genauer gesagt aus Krebsstammzellen. Das gelingt ihnen nicht nur für Darmkrebs, sondern auch für weitere Krebserkrankungen wie Magen-, Pankreas-, Brust-, Lungen- oder Eierstockkrebs. Dadurch stehen den Wissenschaftlerinnen und Wissenschaftlern im DKTK für ihre Forschung patientenspezifische Tumor-Organoide verschiedener Krebsarten zur Verfügung, die sie als eine Art „tiefgefrorene Bibliothek“ sammeln. Sie sollen dabei helfen, die individuellen Eigenschaften von Tumoren künftig noch besser zu erkennen.
Deutsches Konsortium für Translationale Krebsforschung (DKTK)
Das Deutsche Konsortium für Translationale Krebsforschung, kurz DKTK, ist eines von sechs Deutschen Zentren der Gesundheitsforschung, die vom Bundesministerium für Bildung und Forschung (BMBF) gefördert werden. Im DKTK bündeln Forscherinnen und Forscher aus mehr als 20 universitären und außeruniversitären Einrichtungen in ganz Deutschland ihre Kräfte im Kampf gegen Krebserkrankungen, um möglichst rasch Ergebnisse der Grundlagenforschung in neue Ansätze zur Prävention, Diagnostik und Behandlung von Krebserkrankungen zu übertragen. Das Deutsche Krebsforschungszentrum (DKFZ) in Heidelberg verbindet sich als Kernzentrum langfristig mit onkologisch besonders ausgewiesenen universitätsmedizinischen Einrichtungen an den sieben Partnerstandorten Berlin, Dresden, Essen/Düsseldorf, Frankfurt/Mainz, Freiburg, München und Tübingen.
Weitere Informationen über das DKTK unter www.dktk.dkfz.de.
Angriffspunkte finden
Farin untersucht mithilfe der Organoide unter anderem die Bedeutung verschiedener Tumor-Suppressorgene. Dabei handelt es sich um die „Krebsbremsen“ der Zelle. Sie sorgen normalerweise dafür, dass mutierte Zellen absterben und ein Tumor erst gar nicht entstehen kann. Verlieren Tumor-Suppressorgene zum Beispiel durch eine Mutation ihre Funktion, hat dies eine krebsfördernde Wirkung.
Um die Bedeutung der Tumor-Suppressorgene zu untersuchen, schneidet Farin diese mithilfe der Genschere CRISPR-Cas9 aus und untersucht dann den Effekt. Dafür hat er mit seinen Mitarbeitern eine Art biologisches Barcode-System entwickelt. So lässt sich der Effekt mehrerer Tumor-Suppressorgene gleichzeitig untersuchen: Welche Veränderungen tragen dazu bei, dass Therapie-Resistenzen entstehen? Wo hat der Tumor eine Schwachstelle, die sich mit einer Krebsbehandlung gezielt angreifen lässt?
„Es ist uns gelungen, mithilfe der Organoide ein System aufzubauen, mit dem wir individuelle Eigenschaften von Tumoren identifizieren und ihre mögliche Bedeutung für die Therapie ausmachen können“, sagt Farin. „Das heißt, dass wir mit diesem System von den genetischen Besonderheiten eines Tumors auf sein Verhalten rückschließen können.“
In Zukunft sollen die Mini-Därme auch bei Wirkstoffscreenings zum Einsatz kommen. Die Forschenden möchten dadurch herausfinden, auf welche Substanzen die individuellen Tumor-Organoide sensibel reagieren. Erst dann geht der Blick weiter zu den genetischen Eigenschaften, die mit dem beobachteten Wirkstoff-Effekt zusammenhängen könnten.
Das langfristige Ziel ist, Krebserkrankungen noch viel gezielter behandeln zu können, als es derzeit möglich ist. Allerdings sei der Einsatz der Organoide – etwa zur Wahl der geeigneten Therapie in der Klinik – noch in einem Frühstadium, und es sei noch viel Grundlagenforschung nötig, erklärt Farin. „Es gibt jedoch sehr gute Hinweise darauf, dass das Prinzip funktioniert und Versuche an Organoiden tatsächlich eine große Vorhersagekraft für das Therapieansprechen besitzen.“ Gelingt dieser Beweis, könnten die winzigen Tumor-Modelle zukünftig großen Nutzen für Patientinnen und Patienten haben.
DKTK-Organoid-Plattform
Die DKTK-Arbeitsgruppe „Präklinische Organoid-Modelle“ trägt als Plattform mit ihren Expertinnen und Experten zur Weiterentwicklung dieser innovativen Technologie für die klinische Anwendung bei. Durch die Zusammenarbeit wird es möglich, Ressourcen gemeinsam zu nutzen, Protokolle über DKTK-Standorte hinweg zu teilen und Kollaborationen und gemeinsame Projekte anzuregen. Innerhalb des DKTK bündelt die Arbeitsgruppe ein breites Spektrum von Expertisen zu Organoid-Modellen diverser Krebsentitäten. Über die DKTK-Forschungsplattform können Projekte koordiniert und Organoide als Begleitforschung in klinischen Studien integriert werden.
Ansprechpartner:
Dr. Henner Farin
Georg-Speyer-Haus
Institut für Tumorbiologie und experimentelle Therapie
Paul-Ehrlich-Straße 42−44
60596 Frankfurt am Main
069 63395-520
h.farin@dkfz-heidelberg.de
Pressekontakt:
Dr. Nadine Ogrissek
Deutsches Konsortium für Translationale Krebsforschung (DKTK)
Deutsches Krebsforschungszentrum (DKFZ)
Stiftung des öffentlichen Rechts
Im Neuenheimer Feld 280
69120 Heidelberg
06221 42-1646
nadine.ogrissek@dkfz.de