Das angeborene Immunsystem benötigt nicht ein, sondern zwei Signale, um eine Virusinfektion abzuwehren und verhindert so Fehlalarme. Nachwuchsforschende eröffnen mit dieser bislang unbekannten Erkenntnis neue Wege, die Immunabwehr zu stärken.
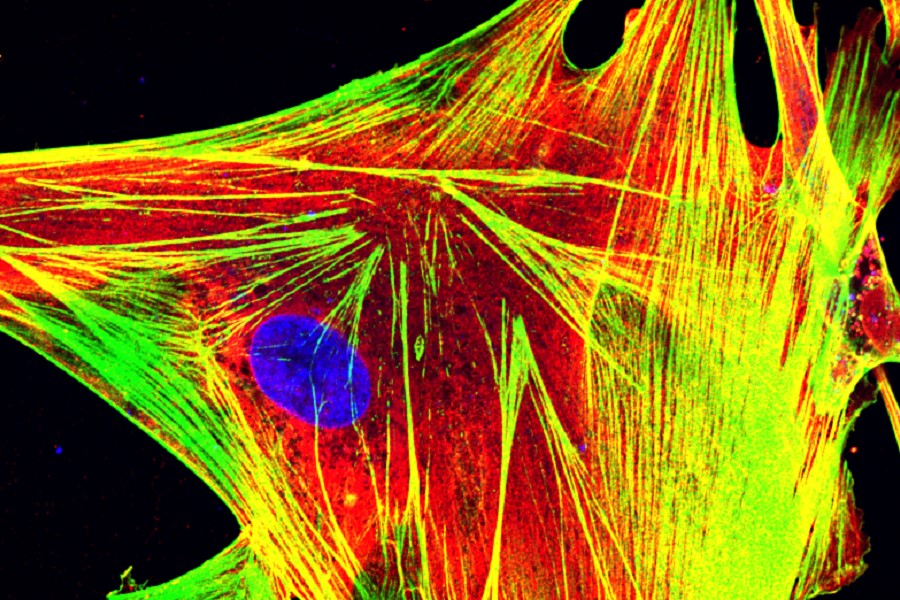
Die Aufnahme zeigt eine Lungenzelle mit Zellkern (blau), in der die Sensorproteine (rot) das Zellskelett (grün) umgeben (gelb) und bei Infektion die Immunabwehr in Gang setzen.
Konstantin Sparrer / Uniklinikum Ulm
Eine Virusinfektion, bspw. mit dem Coronavirus SARS-CoV-2, läuft so ab: Die Erreger dringen in eine Körperzelle ein, um sich zu vermehren. Die Körperzellen wiederum wehren sich gegen den Angriff und leiten mithilfe von Sensoren, die den Erreger an seinen körperfremden Molekülen und Strukturen erkennen, Gegenmaßnahmen ein. Wissenschaftlerinnen und Wissenschaftler waren sich bislang relativ sicher, dass allein das Erkennen der Virusbestandteile durch die Sensoren ausreicht, um rasch die angeborene Immunabwehr über vorgegebene Signalketten zu aktivieren.
Die jüngsten Ergebnisse einer Gruppe von Nachwuchsforschenden des Universitätsklinikums Ulm erfordern nun ein Umdenken und eröffnen dadurch ganz neue Perspektiven. „Wir haben zu unserer Überraschung festgestellt, dass eine volle Immunantwort gar nicht ausgelöst wird, nur weil Viren oder Virusbestandteile in einer Körperzelle sind. Vielmehr muss das Virus außerdem das Skelett bzw. die Struktur der Zelle stören, um als fremd erkannt zu werden“, erklärt Dr. Konstantin Sparrer, dessen Arbeitsgruppe am Uniklinikum Ulm diese neuen Ergebnisse in Zusammenarbeit mit dem Forschungsteam um Prof. Michaela Gack am Florida Research & Innovation Center der Cleveland Clinic erarbeitete.
Sparrers Arbeitsgruppe erforscht im Rahmen ihres vom BMBF geförderten Projektes IMMUNOMOD, wie man Infektionen medikamentös bekämpfen kann – dies aber nicht, indem man die Erreger direkt angreift, sondern indem man die körpereigene Immunabwehr stärkt. Aus diesem Grund befasst sich die Gruppe unter anderem im Detail damit, wie die Kontaktaufnahme zwischen Virus und Körper verläuft. Dabei widmen sie sich vor allem Viren, deren Genom aus einer RNA (Ribonukleinsäure) besteht – sogenannten RNA-Viren. Dazu gehören beispielsweise alle Variationen von Grippeviren (Influenza), das Ebolavirus, aber auch das Hepatitis-D-Virus oder der Tollwuterreger.
Ausgewachsene Zellen verfügen in ihrem Inneren, dem Zytoplasma, über ein Zellskelett. Es besteht aus feinen Eiweißfäden, den sogenannten Proteinfilamenten. Das Zellskelett stabilisiert eine Zelle in ihrer äußeren Form, ermöglicht aber auch die aktive Bewegung der Zelle als Ganzes sowie die Zellteilung und den Transport von Stoffen innerhalb einer Zelle. Bei Infektionen, das zeigen nun die neuen Ergebnisse, spielt das Zellskelett eine wichtige Rolle, denn es hilft dabei, Erreger zu erkennen und das angeborene Immunsystem zu aktivieren.
Die Sensoren, die die RNA-Viren im Inneren der Zelle erkennen und schlussendlich die Immunreaktion aktivieren, sind sogenannte RIG-like-Rezeptoren (RLR). Sie gehören zu einer ganzen Gruppe von Rezeptoren, die in fast allen Körpergeweben darüber wachen, ob Krankheitserreger in die Zellen eindringen. Das erkennen sie an körperfremden Molekülen und Strukturen der Erreger – beispielsweise registrieren die RLR-Rezeptoren die Nukleinsäuren in der RNA von Viren.
Erst die Veränderungen am Zellskelett lösen die Immunantwort aus
Die beiden Forschungsteams aus Ulm und Florida haben nun festgestellt, dass die RLR erst aktiviert werden, wenn noch ein weiteres Signal dazukommt: Veränderungen am Skelett der infizierten Zellen. Alle Körperzellen besitzen ein aus Eiweißen (Proteine) aufgebautes Skelett in ihrem Inneren, das sogenannte Zellskelett (siehe Infokasten). Viren nutzen dieses Zellskelett, beispielsweise um sich innerhalb der Zelle zu bewegen oder auch als Gerüst, um die eigene Virushülle zusammenzubauen und die Zelle zu verlassen. All diese Aktivitäten des Virus führen zu Veränderungen am Zellskelett. Wahrgenommen wird das von Proteinen, die auf dem Zellskelett sitzen: die R12C. Diese Proteine kannte man schon vorher, aber dass sie die Funktion eines Sensors übernehmen, der die RNA-Virus-bedingten Veränderungen des Zellskeletts erkennt, war bislang unbekannt. Der Nachweis gelang dem Forschungsteam, indem es die R12C-Sensorproteine deaktivierte. Daraufhin gab es tatsächlich keine Immunreaktion mehr. Das zeigte: Die reine Anwesenheit eines RNA-Virus oder seiner Bestandteile in der Zelle reichen nicht, um das Immunsystem zu aktivieren.
Aktivierung des Abwehrsystems nur im Gefahrenfall
„Die Entdeckung dieses 2-Signal-Mechanismus ist deswegen so bemerkenswert, weil wir damit besser erklären können, wie der Körper spezifisch Infektionen erkennt und nur im Gefahrenfall auch Alarm schlägt“, erläutert Sparrer. Prinzipiell könne es nämlich vorkommen, dass beispielweise aufgrund einer Mutation die RLR nicht mehr in der Lage sind, korrekt zwischen körpereigenen und Virus-Molekülen zu unterscheiden. Mit dem zweiten Signal werde in solchen Situationen eine unnötige oder sogar fehlerhafte Aktivierung des angeborenen Immunsystems mit all den negativen Folgen bis hin zu einer Autoimmunerkrankung verhindert.
Erkenntnisse gelten auch für Coronavirus SARS-CoV-2
Die Forschungsteams testeten diesen Mechanismus mit verschiedenen RNA-Viren, darunter auch Grippeviren und das aktuell grassierende Coronavirus SARS-CoV-2, und fanden, dass der Mechanismus breit für verschiedenste RNA-Virus-Familien gilt. Mit ihren Arbeiten haben die Nachwuchsforschenden ein Dogma gebrochen und damit einen sehr wichtigen Beitrag für die weitere Erforschung der Immunabwehr geleistet. Das wird letztlich auch Auswirkungen auf die Versorgung von betroffenen Patientinnen und Patienten haben, denn aus den Ergebnissen erschließen sich ganz neue Ansatzpunkte für die Behandlung von Infektionen mit RNA-Viren wie SARS-CoV-2. Sparrer erklärt: „Weil wir jetzt viel besser verstehen, wie die Immunabwehr funktioniert, könnte man nun auch neue Wege finden, um dem angeborenen Immunsystem dabei zu helfen, gegen Viren vorzugehen. Oder man könnte daraus lernen, wie man Adjuvantien, also die Wirkverstärker in Impfstoffen, effektiver macht.“
Über die Richtlinie zur Förderung von Nachwuchsgruppen in der Infektionsforschung unterstützt das Bundesministerium für Bildung Forschung (BMBF) das Projekt „IMMUNOMOD“ von 2020 - 2025 mit ca. 1,8 Millionen Euro. Ziel dieser Fördermaßnahme ist es, die Karriere qualifizierter Nachwuchswissenschaftlerinnen und Nachwuchswissenschaftler in der klinischen und anwendungsorientierten Infektionsforschung gezielt zu fördern und die wissenschaftliche Basis in der Infektionsforschung in Deutschland zu stärken.