Sie sind klein, flink und schwarz-weiß gestreift: Zebrafische sind beliebte Bewohner in heimischen Aquarien. Doch auch in der Forschung haben die possierlichen Tierchen einen festen Platz. Sie helfen Wissenschaftlerinnen und Wissenschaftlern dabei, die Funktion einzelner Gene bei der Organentwicklung zu verstehen. Kürzlich konnte mit ihrer Hilfe ein Gen gefunden werden, das eine Herzschwäche verursacht. (Newsletter 67 / April 2014)
 Die Herzspezialistinnen Dr. Anne-Karin Arndt, Klinik für angeborene Herzfehler und Kinderkardiologie am Universitätsklinikum Kiel, und Privatdozentin Dr. Sabine Klaassen von der Charité Berlin und dem Max-Delbrück-Centrum für Molekulare Medizin kümmern sich um ganz besondere Herzen: um die Herzen von Kindern mit angeborenen Herzfehlern. Jedes Jahr kommen in Deutschland rund 6.000 Babys mit einem angeborenen Herzfehler zur Welt. Dazu zählen auch Kinder mit 1p36-Deletionssyndrom. Den Betroffenen fehlt ein Teil von Chromosom Nummer 1 und damit auch eine Reihe wichtiger Gene. Deshalb sind die Symptome dieser genetischen Erkrankung mannigfaltig. So ist unter anderem ihre körperliche und geistige Entwicklung deutlich verzögert. Viele haben Seh- und Hörstörungen, und rund ein Viertel der Kinder hat einen angeborenen Herzfehler: Der Wandaufbau ihrer linken Herzkammer ist gestört, was zu einer frühzeitigen Herzmuskelschwäche, der Kardiomyopathie, führt. Für diesen besonderen angeborenen Herzfehler interessierten sich Arndt und Klaassen seit einigen Jahren. Für die Wissenschaftlerinnen war klar: Eines der Gene auf dem verlorenen gegangenen Anschnitt von Chromosom 1 muss für diese Herzfehlbildung verantwortlich sein. Aber welches?
Die Herzspezialistinnen Dr. Anne-Karin Arndt, Klinik für angeborene Herzfehler und Kinderkardiologie am Universitätsklinikum Kiel, und Privatdozentin Dr. Sabine Klaassen von der Charité Berlin und dem Max-Delbrück-Centrum für Molekulare Medizin kümmern sich um ganz besondere Herzen: um die Herzen von Kindern mit angeborenen Herzfehlern. Jedes Jahr kommen in Deutschland rund 6.000 Babys mit einem angeborenen Herzfehler zur Welt. Dazu zählen auch Kinder mit 1p36-Deletionssyndrom. Den Betroffenen fehlt ein Teil von Chromosom Nummer 1 und damit auch eine Reihe wichtiger Gene. Deshalb sind die Symptome dieser genetischen Erkrankung mannigfaltig. So ist unter anderem ihre körperliche und geistige Entwicklung deutlich verzögert. Viele haben Seh- und Hörstörungen, und rund ein Viertel der Kinder hat einen angeborenen Herzfehler: Der Wandaufbau ihrer linken Herzkammer ist gestört, was zu einer frühzeitigen Herzmuskelschwäche, der Kardiomyopathie, führt. Für diesen besonderen angeborenen Herzfehler interessierten sich Arndt und Klaassen seit einigen Jahren. Für die Wissenschaftlerinnen war klar: Eines der Gene auf dem verlorenen gegangenen Anschnitt von Chromosom 1 muss für diese Herzfehlbildung verantwortlich sein. Aber welches?
Molekularer Schalter verursacht Herzschwäche
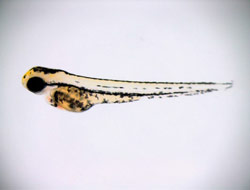 Ein zwei Tage alter gesunder Zebrafisch. Zebrafische sind beliebte Modellorganismen in der Herzforschung, weil die Entwicklung des Herzens in den durchsichtigen Embryonen gut beobachtet werden kann.Um das herauszufinden, haben Arndt und Klaassen gemeinsam mit ihren zahlreichen Kooperationspartnern, unter anderem in enger Zusammenarbeit mit Professor Dr. Reiner Siebert vom Institut für Humangenetik an der Christian-Albrechts-Universität Kiel, die genetische Information von herzkranken Kindern mit 1p36-Deletionssyndrom exakt mit der von Gesunden verglichen. Diese genaue Kartierung der auf dem Chromosom 1 verlorenen genetischen Information zeigte, dass ein einziges Gen für die spezielle Herzfehlbildung hauptverantwortlich ist: das Gen PRDM16. PRDM16 enthält die genetische Information für einen Transkriptionsfaktor. Diese molekularen Schalter können Gene an- und abschalten. Für PRDM16 war bislang nur bekannt, das es eine Funktion im Fettgewebe hat. „Doch PRDM16 kommt auch im Zellkern von Herzmuskelzellen vor und spielt dort anscheinend eine wichtige Rolle“, berichtet Klaassen. Denn: Fehlt das Gen PRDM16 ganz oder teilweise – wie beim 1p36-Deletionssyndrom –, kann der Transkiptionsfaktor seine Aufgabe nicht erfüllen. Als Folge ist die Funktionsfähigkeit des Herzens drastisch eingeschränkt.
Ein zwei Tage alter gesunder Zebrafisch. Zebrafische sind beliebte Modellorganismen in der Herzforschung, weil die Entwicklung des Herzens in den durchsichtigen Embryonen gut beobachtet werden kann.Um das herauszufinden, haben Arndt und Klaassen gemeinsam mit ihren zahlreichen Kooperationspartnern, unter anderem in enger Zusammenarbeit mit Professor Dr. Reiner Siebert vom Institut für Humangenetik an der Christian-Albrechts-Universität Kiel, die genetische Information von herzkranken Kindern mit 1p36-Deletionssyndrom exakt mit der von Gesunden verglichen. Diese genaue Kartierung der auf dem Chromosom 1 verlorenen genetischen Information zeigte, dass ein einziges Gen für die spezielle Herzfehlbildung hauptverantwortlich ist: das Gen PRDM16. PRDM16 enthält die genetische Information für einen Transkriptionsfaktor. Diese molekularen Schalter können Gene an- und abschalten. Für PRDM16 war bislang nur bekannt, das es eine Funktion im Fettgewebe hat. „Doch PRDM16 kommt auch im Zellkern von Herzmuskelzellen vor und spielt dort anscheinend eine wichtige Rolle“, berichtet Klaassen. Denn: Fehlt das Gen PRDM16 ganz oder teilweise – wie beim 1p36-Deletionssyndrom –, kann der Transkiptionsfaktor seine Aufgabe nicht erfüllen. Als Folge ist die Funktionsfähigkeit des Herzens drastisch eingeschränkt.
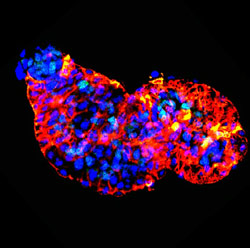 Zwei Tage altes Zebrafisch-Herz unter dem Fluoreszenz-Mikroskop – oben links ist die Herzkammer, unten rechts der Vorhof zu sehen. Fehlt den Zebrafischen das PRDM16-Gen sind ihre Herzen in Struktur und Funktion verändert.Bei weiteren Untersuchungen fanden die Medizinerinnen ähnliche Mutationen im PRDM16-Gen auch bei Patientinnen und Patienten mit einer isolierten Form der Kardiomyopathie der linken Herzkammer. Diese Patienten haben keine weiteren Symptome einer 1p36-Deletion. „Auch hier haben wir genetische Veränderungen gefunden, die die Funktion
des Transkiptionsfaktors PRDM16 beeinträchtigen“, beschreibt Klaassen. Zudem konnte das Team zeigen, dass auch bei einigen Personen mit dilatativer Kardiomyopathie, einer krankhaften Erweiterung des Herzmuskels, das Erbgut im Bereich von PRDM16 verändert ist. „Zwar haben wir diese Mutation nur in fünf von 131 Gewebeproben bei Patienten mit dilatativer Kardiomyopathie gefunden, dagegen aber kein einziges Mal bei 6.400 Kontrollpersonen“, sagt Klaassen, die Kinderkardiologin und Wissenschaftlerin am Berliner Standort des Deutschen Zentrums für Herz-Kreislauf-Forschung (DZHK) ist. Damit ist klar: Genetische Veränderungen im PRDM16-Gen sind für unterschiedliche Formen von Kardiomyopathien verantwortlich. „PRDM16 ist also ein neues Krankheitsgen für Herzschwäche!“
Zwei Tage altes Zebrafisch-Herz unter dem Fluoreszenz-Mikroskop – oben links ist die Herzkammer, unten rechts der Vorhof zu sehen. Fehlt den Zebrafischen das PRDM16-Gen sind ihre Herzen in Struktur und Funktion verändert.Bei weiteren Untersuchungen fanden die Medizinerinnen ähnliche Mutationen im PRDM16-Gen auch bei Patientinnen und Patienten mit einer isolierten Form der Kardiomyopathie der linken Herzkammer. Diese Patienten haben keine weiteren Symptome einer 1p36-Deletion. „Auch hier haben wir genetische Veränderungen gefunden, die die Funktion
des Transkiptionsfaktors PRDM16 beeinträchtigen“, beschreibt Klaassen. Zudem konnte das Team zeigen, dass auch bei einigen Personen mit dilatativer Kardiomyopathie, einer krankhaften Erweiterung des Herzmuskels, das Erbgut im Bereich von PRDM16 verändert ist. „Zwar haben wir diese Mutation nur in fünf von 131 Gewebeproben bei Patienten mit dilatativer Kardiomyopathie gefunden, dagegen aber kein einziges Mal bei 6.400 Kontrollpersonen“, sagt Klaassen, die Kinderkardiologin und Wissenschaftlerin am Berliner Standort des Deutschen Zentrums für Herz-Kreislauf-Forschung (DZHK) ist. Damit ist klar: Genetische Veränderungen im PRDM16-Gen sind für unterschiedliche Formen von Kardiomyopathien verantwortlich. „PRDM16 ist also ein neues Krankheitsgen für Herzschwäche!“
Forschung im Aquarium
 Chromosomen sind die Träger der genetischen Information. Fehlt ein Chromosom oder auch nur ein Teil, gehen wichtige genetische Informationen verloren. So auch beim 1p36-Deletionssyndrom.Aber was genau ist die Funktion des Transkriptionsfaktors PRDM16 im Herzen? Um das zu verstehen, ist Arndt weit gereist. Von der Uniklinik Kiel in ein Forschungslabor nach Boston, USA. „Dort hatte ich die Möglichkeit, Zebrafische zu züchten, die ein verändertes oder gar kein PRDM16-Gen tragen“, beschreibt Arndt. Anschließend konnte sie exakt beobachten und besser verstehen, welche Auswirkungen der Verlust von PRDM16 auf die Entwicklung und Funktion des Herzens hat. Ein solch transgener Zebrafisch hatte ebenfalls eine Herzschwäche und zeigte zusätzlich ein abnormes Wachstum des Herzgewebes sowie eine Veränderung der Zellkontakte.
Chromosomen sind die Träger der genetischen Information. Fehlt ein Chromosom oder auch nur ein Teil, gehen wichtige genetische Informationen verloren. So auch beim 1p36-Deletionssyndrom.Aber was genau ist die Funktion des Transkriptionsfaktors PRDM16 im Herzen? Um das zu verstehen, ist Arndt weit gereist. Von der Uniklinik Kiel in ein Forschungslabor nach Boston, USA. „Dort hatte ich die Möglichkeit, Zebrafische zu züchten, die ein verändertes oder gar kein PRDM16-Gen tragen“, beschreibt Arndt. Anschließend konnte sie exakt beobachten und besser verstehen, welche Auswirkungen der Verlust von PRDM16 auf die Entwicklung und Funktion des Herzens hat. Ein solch transgener Zebrafisch hatte ebenfalls eine Herzschwäche und zeigte zusätzlich ein abnormes Wachstum des Herzgewebes sowie eine Veränderung der Zellkontakte.
Der Zebrafisch ist ein beliebter Modellorganismus in der Herzforschung. Denn die Zebrafisch-Embryonen entwickeln sich vollständig außerhalb der Mutter und sind durchsichtig. So kann die Entwicklung des Herzens und anderer Organe unter dem Mikroskop beobachtet werden. „Es ist ein Meilenstein zu wissen, dass PRDM16 ebenfalls eine wichtige Funktion im Herzen hat. Im nächsten Schritt bietet sich nun die Chance, basierend auf diesem Verständnis neue Medikamente zu entwickeln.“
Doch welche Bedeutung haben die Forschungsergebnisse für Kinder mit einem angeborenen Herzfehler? Arndt: „Diese Frage wird oft von Kinderkardiologen gestellt. Denn einen einmal entstandenen Herzfehler kann man ja nicht mehr rückgängig machen. Durch unsere Experimente eröffnet sich jedoch die Möglichkeit, Substanzen oder Medikamente zu finden, die zum Beispiel die Herzfunktion verbessern. Mithilfe des Zebrafischmodells können wir das testen. Wir haben bereits erste Hinweise für interessante Substanzen. Aber auch für die genetische Beratung hinsichtlich der Vererbbarkeit bestimmter Herzfehler ist unsere Forschung bedeutsam. Und irgendwann einmal für die individualisierte Medizin, durch die erklärt werden kann, warum ein Medikament bei einem Menschen wirkt, bei einem anderen nicht.“
 Um die Ursache eines angeborenen Herzfehlers zu verstehen, brauchen die Wissenschaftlerinnen und Wissenschaftler möglichst viele Gewebeproben von Patienten mit genau diesem Herzfehler. Das ist logistisch sehr aufwendig. Zunächst müssen die Patienten davon überzeugt werden, eine Blut- oder Gewebeprobe zu spenden. Anschließend müssen die Proben fachgerecht gelagert und die vertraulichen Patientendaten separat gesichert werden. Erst wenn eine solche Biomaterial- und Patientendatenbank meist über Jahre aufgebaut wurde, kann die Wissenschaft anfangen, die Proben für Forschungszwecke zu nutzen.
Um die Ursache eines angeborenen Herzfehlers zu verstehen, brauchen die Wissenschaftlerinnen und Wissenschaftler möglichst viele Gewebeproben von Patienten mit genau diesem Herzfehler. Das ist logistisch sehr aufwendig. Zunächst müssen die Patienten davon überzeugt werden, eine Blut- oder Gewebeprobe zu spenden. Anschließend müssen die Proben fachgerecht gelagert und die vertraulichen Patientendaten separat gesichert werden. Erst wenn eine solche Biomaterial- und Patientendatenbank meist über Jahre aufgebaut wurde, kann die Wissenschaft anfangen, die Proben für Forschungszwecke zu nutzen.