Was haben so unterschiedliche Krankheiten wie Muskelschwäche, Epilepsie, Migräne und Herzrhythmusstörungen gemeinsam? Nicht viel, mag man auf den ersten Blick meinen. Doch bei allen ist die Erregbarkeit von Nerven oder Muskelzellen gestört. In einigen Fällen sind genetisch veränderte Ionenkanäle Verursacher der Krankheit. Ionenkanalerkrankungen oder Kanalopathien nennt man diese seltenen und sehr verschiedenartigen Erbkrankheiten. Viel zu oft haben die Betroffenen jahrelang Beschwerden, bevor ihre Krankheit erkannt wird. Das soll sich mit einem neuen Gentest nun ändern. (Newsletter 66 / Februar 2014)
 Sind die Muskellähmungen ein Zeichen für eine seltene Ionenkanalerkrankung? Ein neuer Gentest bringt Gewissheit.Dennis Hartmann (Namen von der Redaktion geändert) hatte immer wieder diese Symptome. In unregelmäßigen Zeitabständen waren seine Muskeln scheinbar grundlos gelähmt. Meist nach starker körperlicher Anstrengung. Dann ging nichts mehr. Nach einiger Zeit war der Spuk wieder vorbei – fast als wäre nichts gewesen. Sein Hausarzt war ratlos. So etwas hatte er noch nicht gesehen. Wahrscheinlich eine Neurose ohne organische Ursache, vermutete er und schickte Dennis Hartmann zum Psychiater. Ohne Erfolg. Erst Jahre später kam ein Neurologe den Beschwerden auf die Spur. Er nahm Dennis Blut ab und ließ einen neuartigen Gentest machen. Danach war klar: Dennis leidet an einer seltenen muskulären Ionenkanalerkrankung. Ein Gen in seinem Erbgut ist mutiert. Die Folge: Ein Ionenkanal in seiner Muskultur funktioniert nicht richtig und löst die Lähmungsattacken aus.
Sind die Muskellähmungen ein Zeichen für eine seltene Ionenkanalerkrankung? Ein neuer Gentest bringt Gewissheit.Dennis Hartmann (Namen von der Redaktion geändert) hatte immer wieder diese Symptome. In unregelmäßigen Zeitabständen waren seine Muskeln scheinbar grundlos gelähmt. Meist nach starker körperlicher Anstrengung. Dann ging nichts mehr. Nach einiger Zeit war der Spuk wieder vorbei – fast als wäre nichts gewesen. Sein Hausarzt war ratlos. So etwas hatte er noch nicht gesehen. Wahrscheinlich eine Neurose ohne organische Ursache, vermutete er und schickte Dennis Hartmann zum Psychiater. Ohne Erfolg. Erst Jahre später kam ein Neurologe den Beschwerden auf die Spur. Er nahm Dennis Blut ab und ließ einen neuartigen Gentest machen. Danach war klar: Dennis leidet an einer seltenen muskulären Ionenkanalerkrankung. Ein Gen in seinem Erbgut ist mutiert. Die Folge: Ein Ionenkanal in seiner Muskultur funktioniert nicht richtig und löst die Lähmungsattacken aus.
So wie Dennis geht es den meisten Betroffenen mit einer seltenen Ionenkanalerkrankung. „Tatsache ist, dass viele Betroffene eine unzumutbare Odyssee mitmachen, bis ihre Diagnose feststeht. Im Durchschnitt dauert es bis zu sieben Jahre, bis Gewissheit herrscht“, berichtet Professor Frank Lehmann-Horn, Leiter der Division of Neurophysiology an der Universität Ulm und Hertie-Senior-Forschungsprofessor. Er führte in den 80er Jahren Pionierarbeiten an Muskelzellen von Patienten wie Dennis durch, die zur Entdeckung von Kanalopathien beitrugen. Die Diagnosestellung soll zukünftig mit einem neuen Gentest erleichtert werden.
100 auf einen Streich
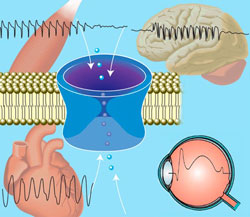 Genetisch veränderte Ionenkanäle verursachen vorübergehend oder dauerhaft auftretende Krankheitssymptome in verschiedensten Organen wie Skelett- und Herzmuskel, Gehirn und Auge.Mehr als 100 Gene kann der Gentest auf einen Streich erfassen. Nur eine kleine Blutprobe ist nötig – schon können alle bekannten Gene untersucht werden,
die mit unterschiedlichen durch Ionenkanaldefekte bedingten Erkrankungen assoziiert sind. Entwickelt wurde der Gentest von Wissenschaftlerinnen und Wissenschaftlern des Forschungsnetzwerks IonNeurONet, das vom Bundesministerium für Bildung und Forschung (BMBF) gefördert wird. „Der Gentest ist ein großer Fortschritt“, sagt Professor Holger Lerche, Ärztlicher Direktor der Abteilung Neurologie mit Schwerpunkt Epileptologie am Uniklinikum Tübingen, der das IonNeurONet koordiniert. „Denn das Problem mit Ionenkanalerkrankungen ist, dass sie selten und vollkommen verschieden sind. Mit unserem Gentest haben wir jetzt innerhalb kürzester Zeit Klarheit, ob eine Ionenkanalerkrankung Ursache der Symptome ist und wenn ja, welche. Dann kann auch gezielter therapiert werden.“
Genetisch veränderte Ionenkanäle verursachen vorübergehend oder dauerhaft auftretende Krankheitssymptome in verschiedensten Organen wie Skelett- und Herzmuskel, Gehirn und Auge.Mehr als 100 Gene kann der Gentest auf einen Streich erfassen. Nur eine kleine Blutprobe ist nötig – schon können alle bekannten Gene untersucht werden,
die mit unterschiedlichen durch Ionenkanaldefekte bedingten Erkrankungen assoziiert sind. Entwickelt wurde der Gentest von Wissenschaftlerinnen und Wissenschaftlern des Forschungsnetzwerks IonNeurONet, das vom Bundesministerium für Bildung und Forschung (BMBF) gefördert wird. „Der Gentest ist ein großer Fortschritt“, sagt Professor Holger Lerche, Ärztlicher Direktor der Abteilung Neurologie mit Schwerpunkt Epileptologie am Uniklinikum Tübingen, der das IonNeurONet koordiniert. „Denn das Problem mit Ionenkanalerkrankungen ist, dass sie selten und vollkommen verschieden sind. Mit unserem Gentest haben wir jetzt innerhalb kürzester Zeit Klarheit, ob eine Ionenkanalerkrankung Ursache der Symptome ist und wenn ja, welche. Dann kann auch gezielter therapiert werden.“
Ionenkanäle haben bei verschiedensten Abläufen im menschlichen Körper eine wichtige Funktion. Es sind Proteine, die in die Zellmembran von beispielsweise Nerven oder Muskelzellen eingelagert sind.
Dort fungieren die Ionenkanäle als selektive Poren für verschiedene Ionen, zum Beispiel Natrium, Kalium oder Chlorid-Ionen. Sie können sich öffnen und schließen und so den Ionenfluss über die Zellmembran beeinflussen. Damit bestimmen sie etwa die elektrische Erregbarkeit der Nervenzellen im Gehirn. „Um ihre Funktion erfüllen zu können, benötigen Nerven, Muskel- und Sinneszellen ähnlich einer Batterie über die Zellmembran hinweg einen ausreichenden elektrischen Ladezustand. Genetische Veränderungen in den Ionenkanälen können vorübergehend oder dauerhaft zu einer Entladung dieser Zellbatterie führen und dadurch Krankheiten verursachen“, erklärt Lehmann-Horn.
Zurück zum Beispiel von Dennis: Seine erbliche Muskelerkrankung wird durch einen zunächst vorübergehenden, später dauerhaften „Leckstrom“ in bestimmten Ionenkanälen der Muskelmembran ausgelöst. Seine „Muskelbatterie“ entlädt sich und kann den Muskelmotor nicht mehr betreiben. Die Folge ist eine Muskelschwäche. „Diese Muskelschwäche verschlimmert sich über die Jahre und führt üblicherweise zum Muskelschwund. Bisher wurde sie für unaufhaltsam und nicht behandelbar gehalten“, berichtet Lehmann-Horn. So auch bei Monika Satt (Name von der Redaktion geändert). Ihre Muskeln waren über die Jahre so schwach geworden, dass sie auf einen Rollstuhl angewiesen war. Umso überraschender war es für die Forscher, dass eine medikamentöse Aufladung der „Muskelbatterie“ tatsächlich zur Wiedergewinnung der Muskelkraft führen kann – auch bei Monika. Diese Aufladung kann mit entwässernden Mitteln, also Diuretika, erreicht werden, die sonst bei Bluthochdruck verordnet werden. „Als besonders geeignet hat sich ein Aldosteron-Antagonist erwiesen. Das gibt Betroffenen die Hoffnung, dass es auch für diese seltene Krankheit eine wirksame Therapie gibt.“ Monika kann – seit sie das Medikament nimmt – wieder gehen. Auch Dennis hofft, seine Lähmungserscheinungen mit einem Diuretikum in den Griff zu bekommen.
Selten und unbekannt
Ionenkanalerkrankungen wie die von Dennis und Monika sind selten. In Deutschland gibt es schätzungsweise 28.000 Betroffene. „Interessanterweise gibt es einige Mutationen, deren Ursprung wir regelrecht zurückverfolgen können“, beschreibt Professorin Karin Jurkat-Rott, die ebenfalls in Ulm an Muskelerkrankungen forscht. Von einer Mutation weiß die Forscherin beispielsweise, dass alle Menschen, die diese Mutation tragen, von einem Urahn aus der Bielefelder Region abstammen. „Meist haben Ärzte diese Erkrankungen nicht im Blick, weil sie viel zu selten Kontakt mit Betroffenen haben“, sagt Lerche. Eine wichtige Aufgabe des IonNeurONet ist deshalb, Medizinerinnen und Mediziner über diese seltenen Erbkrankheiten zu informieren. „Wir organisieren Fortbildungsveranstaltungen, auf denen wir den Ärzten klare Erkennungssignale an die Hand geben, die auf eine Kanalopathie hinweisen“, so Lerche.
Gewitter im Gehirn
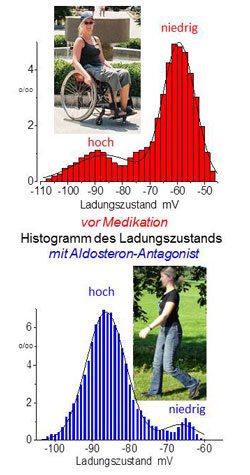 Ist die „Muskelbatterie“ aufgeladen, kommt die Muskelkraft zurück. Oben: Patientin mit Muskelschwäche infolge einer elektrischen Teilentladung der Muskelzellen. Hier überwiegen Muskelzellen mit niedrigem Ladezustand. Die Muskeln der Patientin sind schwach, sie ist auf einen Rollstuhl angewiesen. Unten: Durch die medikamentöse Aufladung der „Muskelbatterie“ mit Hilfe eines Aldosteron-Antagonisten kann die Patientin wieder gehen. Nun überwiegen Muskelzellen mit hohem Ladezustand.Funktionsstörungen von Ionenkanälen spielen auch bei der Entstehung von Epilepsien eine zentrale Rolle. So auch bei den häufigsten Epilepsieformen bei Kindern, den idiopathischen fokalen Epilepsien. Diese treten ohne erkennbare Ursache auf und betreffen nur bestimmte Hirnregionen. Charakteristisch für diese Erkrankungen ist ein Anfallsursprung in der sogenannten Rolandischen Region des Gehirns.
Ist die „Muskelbatterie“ aufgeladen, kommt die Muskelkraft zurück. Oben: Patientin mit Muskelschwäche infolge einer elektrischen Teilentladung der Muskelzellen. Hier überwiegen Muskelzellen mit niedrigem Ladezustand. Die Muskeln der Patientin sind schwach, sie ist auf einen Rollstuhl angewiesen. Unten: Durch die medikamentöse Aufladung der „Muskelbatterie“ mit Hilfe eines Aldosteron-Antagonisten kann die Patientin wieder gehen. Nun überwiegen Muskelzellen mit hohem Ladezustand.Funktionsstörungen von Ionenkanälen spielen auch bei der Entstehung von Epilepsien eine zentrale Rolle. So auch bei den häufigsten Epilepsieformen bei Kindern, den idiopathischen fokalen Epilepsien. Diese treten ohne erkennbare Ursache auf und betreffen nur bestimmte Hirnregionen. Charakteristisch für diese Erkrankungen ist ein Anfallsursprung in der sogenannten Rolandischen Region des Gehirns.
Wissenschaftlerinnen und Wissenschaftlern des IonNeurONet ist es in Kooperation mit anderen Forschungsgruppen gelungen, das erste Krankheitsgen für idiopathische fokale Epilepsien zu identifizieren. Es handelt sich dabei um das Gen GRIN2A. Die entdeckten Veränderungen des Gens GRIN2A stören die Funktion des sogenannten NMDA-Rezeptors, eines wichtigen Ionenkanals im Gehirn. Die Mutationen beeinflussen somit die elektrische Erregbarkeit von Nervenzellen. Dies kann vermehrte elektrische Entladungen im Gehirn und damit das Auftreten epileptischer Anfälle erklären. Der Schweregrad der Epilepsie scheint dabei vom Schweregrad der Mutation abhängig zu sein. Für die Studie haben die Forscher das Genmaterial von insgesamt 400 Patientinnen und Patienten mit idiopathischer fokaler Epilepsie untersucht. Bei 7,5 Prozent der Erkrankten fanden sie Veränderungen des Gens GRIN2A. „Unsere Entdeckung gibt uns erstmals Hinweise auf den zugrunde liegenden Krankheitsmechanismus dieser häufigen Epilepsieformen des Kindesalters“, berichtet Dr. Dr. Saskia Biskup vom Hertie-Institut in Tübingen und Geschäftsführerin der Firma CeGaT GmbH, die den Gentest für Ionenkanalerkrankungen und einen ähnlichen entwickelt hat, der mehr als 300 Epilepsie-Gene erfasst. Trotz dieses Erfolgs liegt noch viel Arbeit vor den Hirnforschern. Denn der genaue Mechanismus, der von der Genveränderung zur Epilepsie-Erkrankung führt, ist noch unverstanden. Das Verständnis dieser Vorgänge ist jedoch Voraussetzung für die Entwicklung neuer, besser wirksamer und verträglicherer Medikamente. Bereits heute wirken die meisten zur Behandlung von Epilepsie eingesetzten Medikamente über Ionenkanäle und bremsen so überaktive Nervenzellen.
IonNeurONet – Ein Netzwerk für effiziente Versorgung
Das Deutsche Netzwerk für neurologische und ophthalmologische Ionenkanalerkrankungen, kurz IonNeurONet, wird seit 2012 vom BMBF gefördert. Ziel des IonNeurONet-Projekts ist es, ein klinisches und Forschungsnetzwerk für Ionenkanalerkrankungen aufzubauen und eine nationale Versorgung für diese seltenen und oftmals unerkannten Erkrankungen bereitzustellen. Zudem sollen Erkrankungsmechanismen aufgeklärt werden, die als Basis für die Entwicklung neuer Therapien dienen können.
Am 28.2. ist der Tag der Seltenen Erkrankungen!
Seltene Erkrankungen sind, in der Summe betrachtet, nicht selten: Ihre Gesamtzahl wird auf 7.000 bis 8.000 geschätzt. Rund vier Millionen Menschen sind in Deutschland betroffen.
Menschen mit einer seltenen Erkrankung haben vieles gemeinsam: Der Weg zu einer gesicherten Diagnose ist häufig langwierig. Liegt eine Diagnose vor, stehen nicht immer Therapien zur Verfügung. Die meisten seltenen Erkrankungen sind genetischen Ursprungs und treten bereits im Kindesalter auf. Um die Situation von Menschen mit seltenen Erkrankungen zu verbessern, unterstützt das Bundesministerium für Bildung und Forschung interdisziplinäre wissenschaftliche Verbünde, die die Ursachen und Therapien von seltenen Erkrankungen erforschen. Derzeit sind 12 Forschungsverbünde in der Förderung. Ihnen stehen neueste Technologien zur Genomforschung, wie das Next Generation Sequencing, zur Verfügung. Unterstützt werden die Verbünde durch ein Koordinierungszentrum.
Näheres zu den Krankheitsgruppen, den wissenschaftlichen Fragestellungen sowie Kontakte finden sich unter: www.research4rare.de.
Ansprechpartner:
Prof. Dr. Holger Lerche
Abteilung Neurologie mit Schwerpunkt Epileptologie
Hertie Institut für Klinische Hirnforschung
Universität Tübingen
Hoppe-Seyler-Str. 3
72076 Tübingen
Tel.: 07071 29-80442
Fax: 07071 29-4488
E-Mail: holger.lerche@med.uni-tuebingen.de