Glioblastome sind besonders aggressive Hirntumore, die sehr schnell auch in das gesunde Hirngewebe hineinwuchern. Die Tumore können deshalb chirurgisch meist nicht vollständig entfernt werden. Steht die Diagnose fest, überleben weniger als drei Prozent der Patientinnen und Patienten die nächsten fünf Jahre. Denn es fehlt an erfolgreichen Behandlungsmöglichkeiten. Derzeit wird ein neuer Wirkstoff klinisch getestet, der das invasive Wachstum der Tumorzellen hemmen soll. Erste Ergebnisse sind erfolgversprechend. (Newsletter 61 / Februar 2013)
 Der Name klingt unscheinbar: APG101. Dahinter verbirgt sich ein neuartiger Wirkstoff, in den Krebsforscher große Hoffnungen setzen. „Hoffentlich zu Recht“, sagt Dr. Harald Fricke von der Firma APOGENIX, die APG101 derzeit in klinischen Studien bei Patientinnen und Patienten mit Glioblastom (medizinisch: Glioblastoma Multiforme) auf seine Wirksamkeit hin untersucht. Kürzlich wurden 84 Patienten, die trotz Operation, Bestrahlung und Chemotherapie einen Rückfall erlitten hatten, in eine Phase II-Studie aufgenommen. Die Patientinnen und Patienten wurden zufällig in zwei Gruppen eingeteilt und entweder mit einer Kombination aus APG101 und Strahlentherapie oder nur mit einer Strahlentherapie behandelt. Das Ergebnis: Mehr als 20 Prozent, also jeder Fünfte der Patientinnen und Patienten, die mit APG101 in Kombination mit einer Strahlentherapie behandelt wurden, zeigten innerhalb von sechs Monaten keine Anzeichen für ein Fortschreiten des Tumors. Mediziner sprechen hierbei von progressionsfreiem Überleben. Im Vergleich hierzu wuchs der Hirntumor in der Gruppe der Patienten, die nur eine Bestrahlung erhielten, nur bei rund vier Prozent nicht weiter.
Der Name klingt unscheinbar: APG101. Dahinter verbirgt sich ein neuartiger Wirkstoff, in den Krebsforscher große Hoffnungen setzen. „Hoffentlich zu Recht“, sagt Dr. Harald Fricke von der Firma APOGENIX, die APG101 derzeit in klinischen Studien bei Patientinnen und Patienten mit Glioblastom (medizinisch: Glioblastoma Multiforme) auf seine Wirksamkeit hin untersucht. Kürzlich wurden 84 Patienten, die trotz Operation, Bestrahlung und Chemotherapie einen Rückfall erlitten hatten, in eine Phase II-Studie aufgenommen. Die Patientinnen und Patienten wurden zufällig in zwei Gruppen eingeteilt und entweder mit einer Kombination aus APG101 und Strahlentherapie oder nur mit einer Strahlentherapie behandelt. Das Ergebnis: Mehr als 20 Prozent, also jeder Fünfte der Patientinnen und Patienten, die mit APG101 in Kombination mit einer Strahlentherapie behandelt wurden, zeigten innerhalb von sechs Monaten keine Anzeichen für ein Fortschreiten des Tumors. Mediziner sprechen hierbei von progressionsfreiem Überleben. Im Vergleich hierzu wuchs der Hirntumor in der Gruppe der Patienten, die nur eine Bestrahlung erhielten, nur bei rund vier Prozent nicht weiter.
Wirksam und sicher
Auch die Lebensqualität der Betroffenen, die mit einem Fragebogen ermittelt wird, kann der neue Wirkstoff verbessern. „Bei 67 Prozent der Patienten, die mit einer Kombination aus APG101 und Strahlentherapie behandelt wurden, konnte ihre Lebensqualität erhalten oder sogar verbessert werden“, beschreibt Dr. Fricke. „Im Gegensatz hierzu verschlechterte sie sich bei 66 Prozent der Patienten, die nur mit einer Strahlentherapie behandelt wurden.“ Während der bis zu zwei Jahre andauernden Behandlung mit der APG101 wurden keine schwerwiegenden Nebenwirkungen beobachtet. „Diese Ergebnisse lassen uns hoffen, dass APG101 eine neue wirksame und zugleich sichere Behandlungsoption für Patientinnen und Patienten mit Glioblastoma Multiforme ist“, fasst Dr. Fricke zusammen. Ob APG101 tatsächlich auch das Leben der Patienten verlängert, müssen nun weitere Studien zeigen.
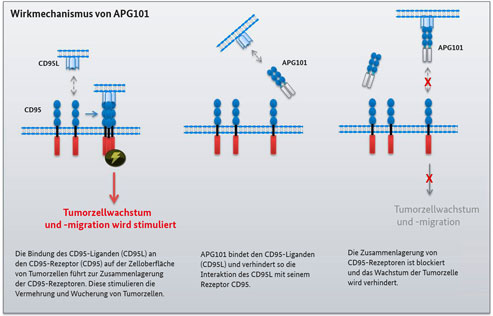
Wie wirkt APG101?
In Laboruntersuchungen hatten Forscher des Deutschen Krebsforschungszentrums (DKFZ) um Prof. Dr. Ana Martin-Villalba entdeckt, dass der Botenstoff CD95L eine wichtige Rolle bei der Wucherung von Glioblastomzellen spielt. „Hemmt man CD95L, verringert sich das invasive Verhalten des Tumors“, beschreibt Professorin Martin-Villalba. Genau das ist die Aufgabe von APG101. Denn APG101 besteht unter anderem aus dem Rezeptor von CD95L, der CD95L bindet und so blockiert.
Nun planen die Mediziner, APG101 weiter klinisch zu prüfen – auch gegen andere Krankheiten.