Lungenkrebs ist die Krebstodesursache Nummer 1. Doch Lungenkrebs ist nicht gleich Lungenkrebs. Es gibt verschiedene Untergruppen, die auch erschieden behandelt werden müssen. Bislang entscheidet der Blick eines Pathologen durch das Mikroskop, welche Form des Lungenkrebses bei einem Patienten oder einer Patientin diagnostiziert wird. Ist diese traditionelle Methode noch genau genug? Neuste Erkenntnisse zeigen, dass eine genetische Analyse der Proben deutlich mehr Informationen über den Tumor liefert. Informationen, die das Leben der Betroffenen verlängern können. (Newsletter 67 / April 2014)
 Jedes Jahr erkranken in Deutschland fast 50.000 Frauen und Männer an Lungenkrebs.Husten musste Dagmar Schuller*) in den letzten Jahren immer viel. Schließlich raucht sie seit Jahren. Doch als ihr Husten gar nicht mehr aufhören wollte, wurde ihr Hausarzt misstrauisch. Eine Röntgenaufnahme zeigte einen Schatten auf ihrer Lunge. Diagnose: Lungenkrebs. Jedes Jahr erkranken in Deutschland fast 50.000 Frauen und Männer an Lungenkrebs. Damit ist Lungenkrebs die dritthäufigste Krebsart in Deutschland, aber unverändert die häufigste Krebstodesursache.
Jedes Jahr erkranken in Deutschland fast 50.000 Frauen und Männer an Lungenkrebs.Husten musste Dagmar Schuller*) in den letzten Jahren immer viel. Schließlich raucht sie seit Jahren. Doch als ihr Husten gar nicht mehr aufhören wollte, wurde ihr Hausarzt misstrauisch. Eine Röntgenaufnahme zeigte einen Schatten auf ihrer Lunge. Diagnose: Lungenkrebs. Jedes Jahr erkranken in Deutschland fast 50.000 Frauen und Männer an Lungenkrebs. Damit ist Lungenkrebs die dritthäufigste Krebsart in Deutschland, aber unverändert die häufigste Krebstodesursache.
Dagmar Schuller hatte Glück. Sie wohnt in der Nähe von Köln und konnte an einer klinischen Studie der Uniklinik Köln teilnehmen. Dabei wurde ihrer Lunge eine Gewebeprobe entnommen und nicht nur unter dem Mikroskop untersucht, sondern auch molekular analysiert. Ein Wissenschaftlerteam um Professor Dr. Roman Thomas, Leiter der Abteilung Translationale Genomik, war auf der Suche nach Genveränderungen, die dabei helfen können, die traditionellen Lungenkrebsuntergruppen genauer zu definieren.
Und siehe da: Nach der mikroskopischen Untersuchung der Gewebeprobe von Frau Schuller stellten die Ärzte die Diagnose „großzelliger Lungenkrebs“. Der „großzellige Lungenkrebs“ gilt bislang als Variante des „nicht kleinzelligen Lungenkrebses“ (non small cell lung cancer, NSCLC) und macht circa 10 bis 15 Prozent aller Lungenkrebsdiagnosen aus. Nach der genetischen Analyse mussten die Ärzte ihre Diagnose allerdings revidieren. Frau Schuller hat eine andere Variante des nicht kleinzelligen Lungenkrebses, aber keinen großzelligen Lungenkrebs. Das hatte auch Konsequenzen für ihre Krebstherapie.
Weltweit erste und größte klinische Studie dieser Art
 Verrät der Blick ins Mikroskop genug über den Tumor?„Bislang wurden die Untergruppen des Lungenkrebses anhand einer Gewebeprobe der Lunge unter dem Mikroskop unterschieden. Wir haben in unserer Studie herausgefunden, dass durch eine sorgfältige Gentypisierung der großzellige Lungenkrebs fast immer den anderen histologischen Untergruppen zugeordnet werden kann“, erklärt Thomas. Damit verändert sich die Klassifizierungssystematik der Erkrankung drastisch. Auf Dauer könnte die Diagnose „großzelliger Lungenkrebs“ tatsächlich überflüssig werden, vermutet Professor Dr. Reinhard Büttner, Direktor des Instituts für Pathologie der Uniklinik Köln und einer der Leiter der Studie. In der weltweit ersten und größten klinischen Studie dieser Art wurde das Lungenkrebsgewebe von mehr als 5.000 Patientinnen und Patienten aus Nordrhein-Westfalen sowohl histologisch, also unter dem Mikroskop, als auch molekular untersucht. Basierend auf der molekularen Einteilung wurden die Patienten anschließend behandelt. Finanziell unterstützt wurde die Studie vom Bundesministerium für Bildung und Forschung (BMBF).
Verrät der Blick ins Mikroskop genug über den Tumor?„Bislang wurden die Untergruppen des Lungenkrebses anhand einer Gewebeprobe der Lunge unter dem Mikroskop unterschieden. Wir haben in unserer Studie herausgefunden, dass durch eine sorgfältige Gentypisierung der großzellige Lungenkrebs fast immer den anderen histologischen Untergruppen zugeordnet werden kann“, erklärt Thomas. Damit verändert sich die Klassifizierungssystematik der Erkrankung drastisch. Auf Dauer könnte die Diagnose „großzelliger Lungenkrebs“ tatsächlich überflüssig werden, vermutet Professor Dr. Reinhard Büttner, Direktor des Instituts für Pathologie der Uniklinik Köln und einer der Leiter der Studie. In der weltweit ersten und größten klinischen Studie dieser Art wurde das Lungenkrebsgewebe von mehr als 5.000 Patientinnen und Patienten aus Nordrhein-Westfalen sowohl histologisch, also unter dem Mikroskop, als auch molekular untersucht. Basierend auf der molekularen Einteilung wurden die Patienten anschließend behandelt. Finanziell unterstützt wurde die Studie vom Bundesministerium für Bildung und Forschung (BMBF).
Personalisierte Therapie verlängert Überleben
Die zweite wichtige Erkenntnis der Studie ist, dass die neue, genomisch basierte Klassifikation von Lungenkrebs es ermöglicht, die Patientinnen und Patienten viel gezielter zu behandeln. Experten sprechen von einer individualisierten oder personalisierten Therapie. „Unsere Ergebnisse zeigen, dass eine molekulare Diagnostik gekoppelt mit einer personalisierten Behandlung das Überleben von Lungenkrebspatienten verlängern kann“, betont Thomas. Ein Beispiel: Patientinnen und Patienten, in deren Lungentumor das Studienteam eine genetische Veränderung im EGF-Rezeptor fand, die zum unkontrollierten Wachstum der Krebszellen beiträgt, wurden gezielt mit Tyrosinkinase-Inhibitoren behandelt. Diese Krebsmedikamente hemmen die übermäßige Aktivität des EGF-Rezeptors in den Krebszellen. „Tatsächlich haben die Patienten mit EGFR-Mutation, die wir mit Tyrosinkinase-Inhibitoren behandelt haben, durchschnittlich zwei Jahre länger gelebt als Patienten, die mit einer klassischen Chemotherapie behandelt wurden. Auch Patienten mit einer anderen Veränderung, der ALK-Translokation, lebten durch eine personalisierte Therapie etwa 15 Monate länger“, beschreibt Thomas.
Damit ist klar: Die Patientinnen und Patienten profitieren von der exakten genetischen Diagnose, weil ihre Behandlung auf die genetischen Veränderungen abgestimmt werden kann. So auch bei Frau Schuller, deren Lungentumor ebenfalls eine Mutation im EGF-Rezeptor trägt. Seither wird sie mit einem Tyrosinkinase-Inhibitor behandelt.
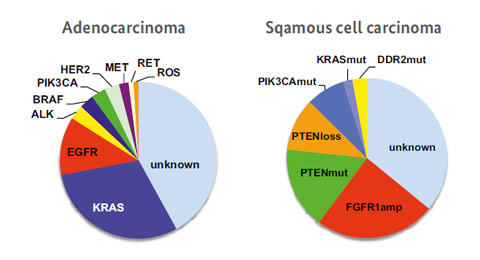
Für die genetischen Veränderungen der zwei dargestellten Untergruppen des nicht kleinzelligen Lungenkrebses stehen bereits teilweise zielgerichtete Therapien zur Verfügung (links: Adenokarzinom, rechts: Plattenepithelkarzinom). Bildquelle: Uniklinik Köln
Molekulare Diagnostik: Zukünftig Routine?
Insgesamt haben die Forscherinnen und Forscher bei etwa der Hälfte der Studienteilnehmenden genetische Veränderungen in den Tumorzellen identifiziert, die sich für derartige zielgerichtete Therapien anbieten. „Daraus leitet sich für uns ab, die molekulare Diagnostik künftig bei der Diagnosesicherung unbedingt zu berücksichtigen. Da wir auch bei anderen Tumorerkrankungen ähnliche Erkenntnisse gewonnen haben, möchten wir die genetischen Untersuchungen schon bald auf alle Krebspatienten ausweiten“, so Professor Dr. Jürgen Wolf, Ärztlicher Leiter des Centrums für Integrierte Onkologie an der Uniklinik Köln und ebenfalls Studienleiter.
Ein Projekt in dieser Größenordnung konnten die Kölner Wissenschaftlerinnen und Wissenschaftler natürlich nicht allein stemmen. „Die Ergebnisse dieser Studie waren nur durch die einzigartige Zusammenarbeit von Wissenschaftlern und Medizinern der Universität und Uniklinik Köln mit nationalen und internationalen Wissenschaftsteams aus verschiedenen Disziplinen sowie Krankenhäusern und niedergelassenen Onkologen möglich“, sagt Thomas.
Ansprechpartnerin:
Dr. Graziella Bosco, Wissenschaftliche Koordinatorin
Abteilung Translationale Genomik
Universität zu Köln
Weyertal 115 b
50931 Köln
Tel.: 0221 478-96861
Fax: 0221 478-97902
E-Mail: gbosco@uni-koeln.de
www.translational-genomics.uni-koeln.de
*) Name von der Redaktion geändert