Sepsis, in der Bevölkerung besser als Blutvergiftung bekannt, ist eine häufige und lebensbedrohliche Krankheit. Auslöser ist eine außer Kontrolle geratene Infektion meist durch Bakterien. Eine schnelle Behandlung mit Antibiotika ist dabei oberstes Gebot. Doch Bakterien sind sehr anpassungsfähig – auch gegenüber Antibiotika. Über Veränderungen in ihren Erbanlagen bilden sie Resistenzen aus. Die Folge: Viele Antibiotika wirken nicht mehr. Wissenschaftlerinnen und Wissenschaftler sind deshalb auf der Suche nach neuen Behandlungsmöglichkeiten gegen die Sepsis. Am Forschungszentrums Borstel sind sie fündig geworden. (Newsletter 70 / Oktober 2014)
Eine Infektion ist für unseren Körper eine Ausnahmesituation, besonders eine schwere Infektion wie die Sepsis. Normalerweise schirmt sich unser Körper wirksam gegen Bakterien, Viren und andere Krankheitserreger ab, so dass diese gar keinen Zutritt zu Blut oder Gewebe bekommen. Doch wenn natürliche Barrieren wie die Haut durchstoßen werden, können Erreger in den Körper eindringen. Bei einer Sepsis verlassen die bakteriellen Eindringlinge oder von ihnen produzierte Gifte den ursprünglichen Entzündungsherd, also zum Beispiel eine Schnittwunde an der Hand, und breiten sich über das Blut im gesamten Körper aus. Es entwickelt sich eine heftige Immunreaktion, die zunehmend außer Kontrolle gerät. Deshalb gilt: Je früher eine Sepsis erkannt wird, desto besser sind die Chancen, sie zu bekämpfen.
Eine Schlüsselrolle bei dieser überschießenden Immunreaktion spielen Lipopolysaccharide, kurz LPS. Diese Moleküle sind wichtige Bestandteile der Zellmembran Gram-negativer Bakterien wie Salmonellen, Escherichia coli oder Legionellen. Freigesetzt werden LPS bei der Zellteilung der Bakterien, wenn das Immunsystem die Bakterien angreift oder bei Behandlungen mit Antibiotika. Bei einer Sepsis werden extrem hohe Konzentrationen an LPS, die auch Endotoxine genannt werden, freigesetzt. Der menschliche Körper erkennt diese als Feind und leitet eine Vielzahl von Abwehrund Entzündungsreaktionen ein. Die Zellen unseres Immunsystems produzieren in einer heftigen, unkontrollierten Reaktion Botenstoffe. Es kommt zu einem gewaltigen Botenstoffsturm. Ein Organ nach dem anderen versagt. Die Folge ist ein septischer Schock.
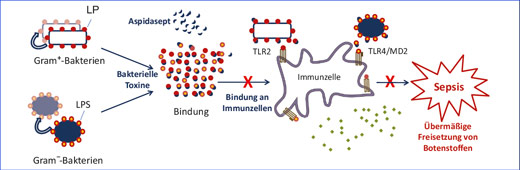
Die Wirkungsweise von Aspidasept: Die kleinen Peptide binden die entzündungsauslösenden bakteriellen Toxine (Lipopolysaccharide,
LPS, bzw. Lipoproteine, LP). So neutralisiert, können sich die Toxine nicht mehr an Zellen des Immunsystems binden. Eine übermäßige
Freisetzung von Botenstoffen und damit die Entstehung einer Sepsis wird verhindert.
Nicht die Bakterien, sondern ihre Gifte werden bekämpft
Bisherige Therapieansätze mit Antibiotika greifen die Bakterien direkt an, fördern dabei aber zugleich die Freisetzung von Endotoxinen. „Dass ausgerechnet Antibiotika, die zur Therapie der Sepsis eingesetzt werden, die Freisetzung des LPS fördern, ist die eigentliche Krux an der Geschichte“, sagt Professor Klaus Brandenburg vom Forschungszentrum Borstel. Das brachte den Infektionsforscher auf eine Idee: Warum nicht statt der Bakterien die von ihnen produzierten entzündungsauslösenden Endotoxine unschädlich machen? Gemeinsam mit einem Team aus Wissenschaftlerinnen und Wissenschaftlern sowie zahlreichen Kooperationspartnern machte er sich auf die Suche: „Wir wollten einen Wirkstoff finden, der die gefährlichen Endotoxine binden kann.
Dadurch bleiben diese Strukturen vom Immunsystem unerkannt. Sie werden unschädlich gemacht und eine überschießende Immunreaktion und deren Folgeerscheinungen wird verhindert.“
Erste Erfolge in Sicht
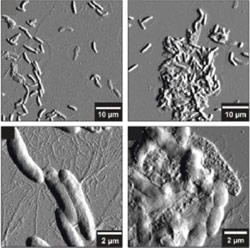 Die Wirkung von Aspidasept auf Salmonellen unter dem Rasterkraftmikroskop. Links: Salmonellen ohne Wirkstoff. Rechts: Salmonellen in Gegenwart von Aspidasept. Die Bakterien ballen sich massiv zusammen und fließen aus.Bereits in den 90er Jahren fanden Wissenschaftler Abschnitte in Proteinen, die über genau diese Bindungsfunktion für das LPS verfügen. Diese kleinen Proteinabschnitte aus 20 bis 50 Aminosäuren hat Brandenburg mit Förderung des Bundesministeriums für Bildung und Forschung (BMBF) im Förderschwerpunkt „Innovative Therapieverfahren“ charakterisiert, künstlich hergestellt und so verändert, dass sie in der Lage sind, die Endotoxin-Flut bei einer Sepsis zu neutralisieren. „Wir mussten Peptide, also kurze Proteine, herstellen, die gleichzeitig mehrere Funktionen erfüllen: Erstens müssen sie positiv geladen sein, um das negativ geladene LPS mit hoher Affinität binden zu können. Und zweitens müssen sie, um wirkungsvoll zu reagieren, wie das LPS amphiphil sein. Das heißt sie müssen wasser- und zugleich fettlöslich sein“, erklärt Brandenburg. Tatsächlich gelang es, diese neue Klasse von Wirkstoffen zu entwickeln.
Die Wirkung von Aspidasept auf Salmonellen unter dem Rasterkraftmikroskop. Links: Salmonellen ohne Wirkstoff. Rechts: Salmonellen in Gegenwart von Aspidasept. Die Bakterien ballen sich massiv zusammen und fließen aus.Bereits in den 90er Jahren fanden Wissenschaftler Abschnitte in Proteinen, die über genau diese Bindungsfunktion für das LPS verfügen. Diese kleinen Proteinabschnitte aus 20 bis 50 Aminosäuren hat Brandenburg mit Förderung des Bundesministeriums für Bildung und Forschung (BMBF) im Förderschwerpunkt „Innovative Therapieverfahren“ charakterisiert, künstlich hergestellt und so verändert, dass sie in der Lage sind, die Endotoxin-Flut bei einer Sepsis zu neutralisieren. „Wir mussten Peptide, also kurze Proteine, herstellen, die gleichzeitig mehrere Funktionen erfüllen: Erstens müssen sie positiv geladen sein, um das negativ geladene LPS mit hoher Affinität binden zu können. Und zweitens müssen sie, um wirkungsvoll zu reagieren, wie das LPS amphiphil sein. Das heißt sie müssen wasser- und zugleich fettlöslich sein“, erklärt Brandenburg. Tatsächlich gelang es, diese neue Klasse von Wirkstoffen zu entwickeln.
„Unsere Peptide sind in der Lage, bakterielle Toxine direkt und breitbandig, das heißt unabhängig von der Art des Bakteriums, zu neutralisieren. Wir nennen sie synthetische anti-LPS Peptide, kurz SALP. Ihr Herzstück ist die LPS-Bindestelle, die wir Aspidasept genannt haben“, so Brandenburg.
Erste präklinische Studien mit Aspidasept waren bereits erfolgreich: Mit der patentierten Substanz gelang es den Wissenschaftlerinnen und Wissenschaftlern, in Kombination mit Antibiotika, Sepsis im Tiermodell erfolgreich zu behandeln. „Das Peptid ist damit ein vielversprechendes neues Therapeutikum gegen Sepsis“, sagt Brandenburg. Weiterführende toxikologische Untersuchungen und klinische Studien sind derzeit in Planung. Bis Aspidasept möglicherweise zur Behandlung der Sepsis zur Verfügung stehen wir, wird es noch einige Jahre dauern. Für die Entwicklung des Wirkstoffes hat er eine Firma aus dem Forschungszentrum Borstel ausgegründet hat, die Brandenburg Antiinfektiva GmbH.
Peptide entpuppen sich als „multi-tasking“
Dass die Peptide vielseitiger sind, als zunächst gedacht, zeigten Untersuchungen mit Gram-positiven Bakterien. Die Zellwand dieser Bakterien ist anders aufgebaut sind als die der Gram-negativen. Bei ihnen lösen nicht Lipopolysaccharide, sondern die Lipoproteine die Entzündungsreaktionen aus. „Wir haben gesehen, dass Aspidasept auch einige Lipoproteine effektiv binden kann. Deshalb sind wir optimistisch, dass auch eine Sepsis, die von Gram-positiven Bakterien ausgelöst wird, mit unseren Peptiden behandelbar sein wird.“ Doch die Peptide können noch mehr. Neben ihrer antibakteriellen Wirkung können sie in Laborexperimenten auch verschiedene Virusinfektionen aufhalten. „Hierbei ist der Wirkmechanismus ist ein anderer als der gegen bakterielle Toxine“, erklärt Brandenburg. „Diese Doppelfunktion eröffnet die Möglichkeit, Aspidasept auch im Falle einer Superinfektion einzusetzen.“ Hierbei schwächt zunächst eine Vireninfektion das Immunsystem. Erst durch eine zweite bakterielle Infektion kommt es zu einer schwereren Erkrankung. „Das war zum Beispiel in den 1920er Jahren bei der ‚Spanischen Grippe‘ der Fall. Die Menschen erkrankten an einem Grippevirus, verstarben aber schließlich an einer bakteriellen Sepsis. Hier könnte Aspidasept als sowohl antibakteriell als auch antiviral wirkendes Peptid helfen.“
Stehen mit dieser neuen Wirkstoffklasse die klassischen Antibiotika nun vor der Ablösung? „Sicher nicht! In der direkten Bekämpfung bakterieller Erreger sind Antibiotika immer noch effektiver und werden es auch bleiben“, betont Brandenburg.