Antibiotika gibt es nicht nur in der Apotheke. Auch unser Körper produziert eigene Substanzen, die ähnlich wie Antibiotika wirken. Diese sind sehr nützlich im Kampf gegen Bakterien, Viren oder Pilze – und auch gegen Problemkeime, bei denen klassische Antibiotika kaum noch Wirkung zeigen. (Newsletter 56 / März 2012)
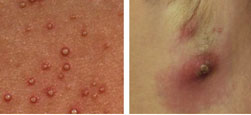 Wenn der körpereigene Schutz fehlt, können Staphylococcus aureus- Bakterien zahlreiche Hautinfektionen auslösen, zum Beispiel Haarbalgentzündungen (links) und Abszesse (rechts).Die Haut ist mehr als nur eine Hülle des Körpers. Sie ist mit einer Gesamtfläche von etwa zwei Quadratmetern eines der größten Organe des Menschen und schützt uns vor äußeren Umwelteinflüssen, Erregern oder Allergenen. Ist die Haut jedoch verletzt, können sich zum Beispiel Bakterien ungehindert dort ansiedeln. Hierfür hat der menschliche Köper effektive Schutzmechanismen entwickelt: antimikrobielle Eiweiße, die wie körpereigene Antibiotika wirken und auf die Haut abgegeben werden. „Die antimikrobiellen Proteine, kurz AMP, sind kleine, evolutionsbiologisch sehr alte Proteine, die Mikroorganismen effizient und schnell abtöten – lange, bevor unser Immunsystem mit der Aktivierung und Bereitstellung von spezialisierten Effektorzellen reagieren kann“, beschreibt Prof. Dr. Regine Gläser von der Universitäts-Hautklinik Kiel. So schützen die antimikrobiellen Proteine die Haut und andere Grenzorgane, also zum Beispiel die Schleimhäute der Nase, als chemische Barriere vor Infektionen.
Wenn der körpereigene Schutz fehlt, können Staphylococcus aureus- Bakterien zahlreiche Hautinfektionen auslösen, zum Beispiel Haarbalgentzündungen (links) und Abszesse (rechts).Die Haut ist mehr als nur eine Hülle des Körpers. Sie ist mit einer Gesamtfläche von etwa zwei Quadratmetern eines der größten Organe des Menschen und schützt uns vor äußeren Umwelteinflüssen, Erregern oder Allergenen. Ist die Haut jedoch verletzt, können sich zum Beispiel Bakterien ungehindert dort ansiedeln. Hierfür hat der menschliche Köper effektive Schutzmechanismen entwickelt: antimikrobielle Eiweiße, die wie körpereigene Antibiotika wirken und auf die Haut abgegeben werden. „Die antimikrobiellen Proteine, kurz AMP, sind kleine, evolutionsbiologisch sehr alte Proteine, die Mikroorganismen effizient und schnell abtöten – lange, bevor unser Immunsystem mit der Aktivierung und Bereitstellung von spezialisierten Effektorzellen reagieren kann“, beschreibt Prof. Dr. Regine Gläser von der Universitäts-Hautklinik Kiel. So schützen die antimikrobiellen Proteine die Haut und andere Grenzorgane, also zum Beispiel die Schleimhäute der Nase, als chemische Barriere vor Infektionen.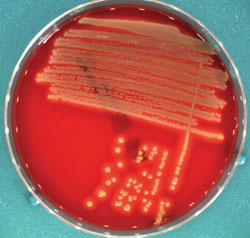 Im Labor wirken sie harmlos: Staphylococcus aureus-Bakterien auf einer Kulturplatte.Einer dieser bakteriellen Übeltäter, der sich bevorzugt auf der Haut und in den Schleimhäuten ansiedelt, ist Staphylococcus aureus. Eine Infektion mit dieser Bakterienart kann zu Haarbalgentzündungen, Entzündungen von Wunden, Abszessen und sogar zu einer Lungenentzündung oder Blutvergiftung führen. Doch ein gesunder Köper ist auch gegen diesen Angreifer gewappnet: „Ein antimikrobielles Protein, die RNase 7, ist besonders wirksam gegen Staphylococcus aureus. Kommen unsere Haut oder die Schleimhäute mit diesen Bakterien in Berührung, wird verstärkt RNase 7 produziert, auf die Haut oder in das Nasensekret abgegeben und die Bakterien so abgetötet“, erklärt Professor Gläser. Bei Patientinnen und Patienten mit chronischen Wunden, also Wunden, die über einen Zeitraum von mindestens sechs Wochen keine Heilungstendenz zeigen, wie etwa bei einer Venenschwäche oder Diabetikern mit einem offenen Bein, funktioniert dieser Schutzmechanismus nicht mehr. Gerade im Randbereich von chronischen Wunden werden bestimmte AMP, wie RNase 7, die gut gegen Staphylococcus aureus wirken, weniger stark gebildet. Chronische Wunden sind dem Bakterium also fast schutzlos ausgesetzt. „Wir vermuten, dass das gehäufte Auftreten von Infektionen mit Staphylococcus aureus in chronischen Wunden genau mit dieser fehlenden Bildung der antimikrobiellen Proteine zusammenhängen könnte“, spekuliert die Expertin.
Im Labor wirken sie harmlos: Staphylococcus aureus-Bakterien auf einer Kulturplatte.Einer dieser bakteriellen Übeltäter, der sich bevorzugt auf der Haut und in den Schleimhäuten ansiedelt, ist Staphylococcus aureus. Eine Infektion mit dieser Bakterienart kann zu Haarbalgentzündungen, Entzündungen von Wunden, Abszessen und sogar zu einer Lungenentzündung oder Blutvergiftung führen. Doch ein gesunder Köper ist auch gegen diesen Angreifer gewappnet: „Ein antimikrobielles Protein, die RNase 7, ist besonders wirksam gegen Staphylococcus aureus. Kommen unsere Haut oder die Schleimhäute mit diesen Bakterien in Berührung, wird verstärkt RNase 7 produziert, auf die Haut oder in das Nasensekret abgegeben und die Bakterien so abgetötet“, erklärt Professor Gläser. Bei Patientinnen und Patienten mit chronischen Wunden, also Wunden, die über einen Zeitraum von mindestens sechs Wochen keine Heilungstendenz zeigen, wie etwa bei einer Venenschwäche oder Diabetikern mit einem offenen Bein, funktioniert dieser Schutzmechanismus nicht mehr. Gerade im Randbereich von chronischen Wunden werden bestimmte AMP, wie RNase 7, die gut gegen Staphylococcus aureus wirken, weniger stark gebildet. Chronische Wunden sind dem Bakterium also fast schutzlos ausgesetzt. „Wir vermuten, dass das gehäufte Auftreten von Infektionen mit Staphylococcus aureus in chronischen Wunden genau mit dieser fehlenden Bildung der antimikrobiellen Proteine zusammenhängen könnte“, spekuliert die Expertin. Viele Köpfe sind an der Arbeit des „Skin Staph“-Verbundes beteiligt: Cornelia Wilgus, Dr. Dr. Ulf Meyer-Hoffert, Prof. Dr. Regine Gläser, Dr. Bente Köten, Prof. Dr. Jürgen Harder und Christel Martensen-Kerl (v. l. n. r.).Die Forscher sind nun dabei, ihre Erkenntnisse auch therapeutisch zu nutzen. Sie sind auf der Suche nach Wirkstoffen, die eine Produktion körpereigener AMP gezielt anregen können und sind dabei, antimikrobielle Proteine künstlich herzustellen. „In Zusammenarbeit mit einer Firma in Kiel haben wir bereits Studien begonnen, um antimikrobielle Proteine als Therapeutikum herzustellen und zu untersuchen. Diese Studien sollen zeigen, ob eine Verabreichung von AMP auf die Haut tatsächlich Infektionen verhindern kann“, beschreibt Professor Gläser. Bei Erfolg wären die antimikrobiellen Proteine somit eine neue Klasse von Antibiotika im Kampf gegen Infektionserkrankungen, die von Staphylococcus aureus verursacht werden. „Das ist nicht nur von wirtschaftlichem, sondern auch von großem gesundheitspolitischen Interesse, da es in den letzten Jahren immer mehr Erkrankungen gibt, die durch Antibiotika-resistente Staphylococcus aureus- Stämme hervorgerufen werden.“ Die Forschungsarbeiten von Professor Gläser und ihren Kolleginnen und Kollegen werden vom Bundesministerium für Bildung und Forschung (BMBF) gefördert und wurden in den vergangenen Jahren mit mehreren Preisen ausgezeichnet.
Viele Köpfe sind an der Arbeit des „Skin Staph“-Verbundes beteiligt: Cornelia Wilgus, Dr. Dr. Ulf Meyer-Hoffert, Prof. Dr. Regine Gläser, Dr. Bente Köten, Prof. Dr. Jürgen Harder und Christel Martensen-Kerl (v. l. n. r.).Die Forscher sind nun dabei, ihre Erkenntnisse auch therapeutisch zu nutzen. Sie sind auf der Suche nach Wirkstoffen, die eine Produktion körpereigener AMP gezielt anregen können und sind dabei, antimikrobielle Proteine künstlich herzustellen. „In Zusammenarbeit mit einer Firma in Kiel haben wir bereits Studien begonnen, um antimikrobielle Proteine als Therapeutikum herzustellen und zu untersuchen. Diese Studien sollen zeigen, ob eine Verabreichung von AMP auf die Haut tatsächlich Infektionen verhindern kann“, beschreibt Professor Gläser. Bei Erfolg wären die antimikrobiellen Proteine somit eine neue Klasse von Antibiotika im Kampf gegen Infektionserkrankungen, die von Staphylococcus aureus verursacht werden. „Das ist nicht nur von wirtschaftlichem, sondern auch von großem gesundheitspolitischen Interesse, da es in den letzten Jahren immer mehr Erkrankungen gibt, die durch Antibiotika-resistente Staphylococcus aureus- Stämme hervorgerufen werden.“ Die Forschungsarbeiten von Professor Gläser und ihren Kolleginnen und Kollegen werden vom Bundesministerium für Bildung und Forschung (BMBF) gefördert und wurden in den vergangenen Jahren mit mehreren Preisen ausgezeichnet.
Eine weitere Frage, die Professor Gläser und ihre Arbeitsgruppe beschäftigt: Warum sind Patienten mit der Hautkrankheit Neurodermitis so viel anfälliger für Staphylococcus- Infektionen als Gesunde? „Wir hatten die Hypothese, dass Neurodermitis-Patienten – ähnlich wie wir es bei Patienten mit chronischen Wunden festgestellt haben – vielleicht zu wenig AMP produzieren“, so Professor Gläser. Aber genau das Gegenteil ist der Fall: Patientinnen und Patienten mit Neurodermitis produzieren im Vergleich zu gesunden Menschen sogar mehr AMP. „So können wir also die häufig auftretenden Infektionen bei Neurodermitis-Patienten also nicht erklären. Wir spekulieren jedoch“, sagt Professor Gläser, „dass die antimikrobiellen Proteine sie vor tiefen Wundinfektionen, die zum Beispiel durch Kratzen entstehen können, schützen.“
Ansprechpartnerin:
Prof. Dr. Regine Gläser
Universitäts-Hautklinik Kiel
Schittenhelmstr. 7
24105 Kiel
Tel.: 0431 597-1512
Fax: 0431 597-1611
E-Mail: rglaeser@dermatology.uni-kiel.de