Ein personalisierter Ansatz in der Krebstherapie nutzt genetisch veränderte menschliche T-Zellen, um Krebszellen zu erkennen und zu eliminieren. Aktuell startet die erste klinische Studie mit Patientinnen und Patienten, die schwer am Multiplen Myelom erkrankt sind.
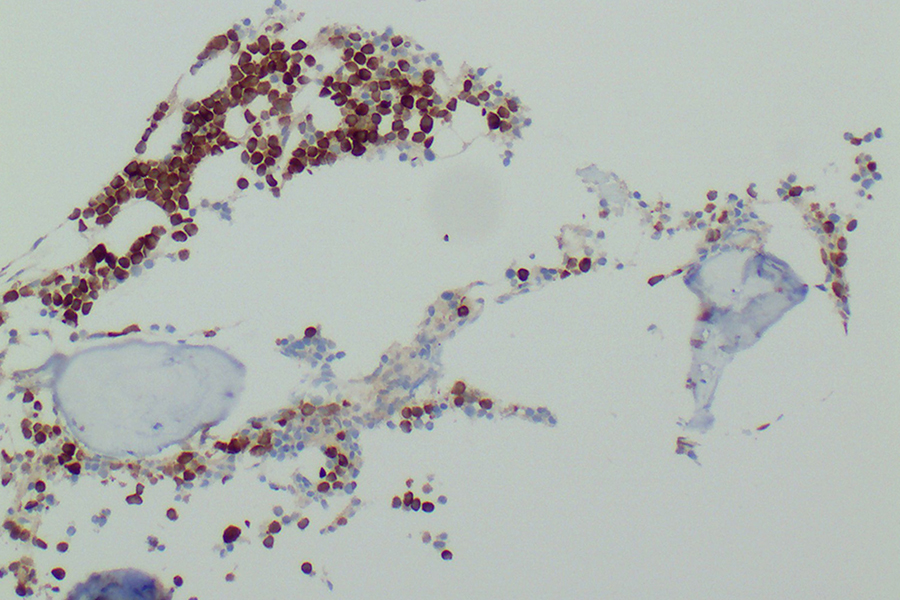
Bei einem Multiplen Myelom enthält das Knochenmark viele entartete Plasmazellen, die das Antigen MAGE-1A (braun) produzieren. Die gentechnisch mit einem MAGE-1A-spezifischen Rezeptor ausgestatteten T-Zellen erkennen das Antigen und bekämpfen die Tumorzellen.
von Brünneck / Charité
Von der Idee bis zum vielversprechenden Behandlungsansatz ist es häufig ein langer und schwieriger Weg: Über 20 Jahre forschten Prof. Dr. Thomas Blankenstein vom Max-Delbrück-Centrum für Molekulare Medizin (MDC) in Berlin und sein Team an einer personalisierten Krebstherapie – nun beginnt die erste, vom Bundesministerium für Bildung und Forschung (BMBF) geförderte klinische Studie mit zwölf Patientinnen und Patienten, mit der die Sicherheit, die Effektivität und die notwendige Dosierung der Therapie untersucht werden sollen.
Bei der T-Zellrezeptor-Gentherapie werden körpereigene Immunzellen, sogenannte T-Zellen, genetisch verändert. Diese veränderten T‑Zellen erkennen anschließend Krebszellen über die für sie typischen Strukturen – Antigene – auf der Zelloberfläche und vernichten sie. „Der Kern unseres Projekts ist die Planung, Durchführung und Auswertung der ersten klinischen Studie mit Patientinnen und Patienten, die am Multiplem Myelom erkrankt sind und keine andere Therapieoption mehr haben“, sagt Projektleiter Prof. Dr. Thomas Blankenstein. „Wenn diese und folgende klinische Studien erfolgreich sind, gehen wir jedoch davon aus, dass das Wirkprinzip auf weitere Krebserkrankungen übertragbar ist.“
Das Bundesministerium für Bildung und Forschung (BMBF) fördert das Verbundprojekt „T-Zellrezeptor-Gentherapie am Beispiel von MageA1 (MAGEA1-TCR)“ in der Fördermaßnahme „Innovationen für die individualisierte Medizin“ mit insgesamt rund 3,8 Millionen Euro. In einer klinischen Phase-I-Studie wird bei Betroffenen mit Multiplem Myelom die neue, personalisierte Gentherapie auf ihre Sicherheit hin überprüft. Es werden noch Studienteilnehmerinnen und -teilnehmer gesucht, die jedoch bestimmte enge Auswahlkriterien erfüllen müssen.
Kontakt: Dr. Matthias Obenaus, E-Mail: matthias.obenaus@charite.de
Weitere Informationen zum Verbundprojekt
https://www.gesundheitsforschung-bmbf.de/de/t-zellrezeptor-gentherapie.php
Ein neuer Ansatz in der personalisierten Krebsmedizin
Die Forschenden vom MDC züchteten zunächst genetisch veränderte Mäuse, die in der Lage sind, T-Zellen mit humanen T-Zellrezeptoren zu produzieren. „Werden diese Mäuse mit einem Antigen von menschlichen Krebszellen immunisiert, vermehren sich in ihr T-Zellen mit passgenauen Rezeptoren gegen dieses Antigen“, sagt Blankenstein. „So konnten wir den genetischen Bauplan dieses Rezeptors gewinnen.“ Bei der Behandlung werden den Patientinnen und Patienten jeweils körpereigene T-Zellen entnommen, diese mit dem neuen Rezeptor versehen und dann über eine Infusion wieder zurück in den Körper gegeben. Dort können die Immunzellen die Krebszellen nach dem Schlüssel-Schloss-Prinzip erkennen und gezielt und effektiv bekämpfen.
Den „Umweg“ über die Maus gingen die Forschenden, weil im Menschen keine derartigen T-Zellen gegen die Krebs-Antigene entstehen können. Die entsprechenden Antigene sind zwar typische Erkennungszeichen auf der Oberfläche von Krebszellen, können aber auch auf anderen Körperzellen vorkommen. T-Zellen mit einem entsprechenden Rezeptor werden daher bei der Entwicklung des Immunsystems aussortiert, um eine Autoimmunreaktion zu vermeiden. „Die genetisch veränderte Maus ist jedoch nicht tolerant für die menschlichen Krebs-Antigene, ihr Immunsystem erkennt sie als fremd und deshalb mobilisiert sie T-Zellen gegen die Krebs-Oberflächenstrukturen,“ so Blankenstein. Im Erwachsenenalter kommt das Antigen MAGE-A1 nur noch im Hoden vor, einem für T-Zellen nicht zugänglichen Organ, so dass das Risiko einer Autoimmunität durch Gabe der genetisch veränderten T-Zellen gering ist.
Auch die bekannten CAR-T-Zelltherapien arbeiten mit einem personalisierten Ansatz: Bei dieser Behandlungsform werden eigene T-Zellen der an Krebs erkrankten Person außerhalb des Körpers ebenfalls gentechnisch verändert, aber mit einem künstlichen Rezeptor ausgestattet, der das entsprechende Antigen erkennt. Für das Erkennen der Tumorzellen ist ein Antikörperfragment zuständig, das an ein auf Tumorzellen vorhandenes Oberflächenantigen bindet. Erste CAR-T-Zelltherapien sind bereits international zugelassen. Während sie bei einigen Blutkrebsarten wie B-Zell-Lymphomen bislang Erfolge zeigten, waren sie bei soliden Tumoren bislang weniger wirksam. Diese Lücke möchte das Team um Blankenstein im weiteren Verlauf ihrer Forschungsarbeiten unter anderem füllen.
Das Multiple Myelom ist eine spezielle Form von Blutkrebs, bei der sich Plasmazellen im Knochenmark unkontrolliert vermehren. Im Knochenmark werden rote und weiße Blutkörperchen produziert. Während die roten Blutkörperchen (Erythrozyten) für den Sauerstofftransport im Körper zuständig sind, werden die weißen Blutkörperchen (Leukozyten) zur Immunabwehr gebildet. Es gibt verschiedene Gruppen von Leukozyten, wie beispielsweise T- oder B-Zellen. Plasmazellen sind ein gereiftes Stadium der B-Zellen und für die Produktion von Antikörpern zuständig. Mit der Zeit verdrängen die krankhaft veränderten Plasmazellen immer mehr gesunde Zellen im Knochenmark, wodurch verschiedene Symptome entstehen können. Mit den etablierten Behandlungsmethoden kann das Multiple Myelom nicht geheilt werden. Ziel der Therapie ist bisher, das Leben der Betroffenen zu verlängern und ihre Lebensqualität zu optimieren.