 Frei Durchatmen – für Patientinnen und Patienten mit chronischen Lungenerkrankungen ist das nicht möglich.20.000 Atemzüge am Tag − ganz selbstverständlich nimmt sich unser Körper, was er braucht: Frische Luft und Sauerstoff sind lebenswichtig für uns. Und doch fällt uns das meist erst auf, wenn wir schlecht Luft bekommen. Wenn wir kurzatmig werden. Für Patientinnen und Patienten mit chronischen Lungenerkrankungen ist dieser Zustand Alltag. Sie leiden ein Leben lang unter Luftnot. Weit verbreitete Lungenerkrankungen sind Asthma und chronische Bronchitis. Es gibt aber auch einige seltene Erkrankungen, in denen die Lungenfunktion eingeschränkt ist. Beispielsweise bei Mukoviszidose (mehr zu diesem Thema erfahren Sie im Beitrag „Mukoviszidose – Beeinträchtigung der Lungen früh und gefahrlos erkennen“). Es gibt noch viele weitere seltene Lungenerkrankungen, bei denen beispielweise lebenswichtige Stoffe nicht gebildet werden, welche die Lunge normalerweise schützen. Die Folge ist immer die gleiche: Lebenswichtiges Lungengewebe wird zerstört und das Atmen fällt immer schwerer.
Frei Durchatmen – für Patientinnen und Patienten mit chronischen Lungenerkrankungen ist das nicht möglich.20.000 Atemzüge am Tag − ganz selbstverständlich nimmt sich unser Körper, was er braucht: Frische Luft und Sauerstoff sind lebenswichtig für uns. Und doch fällt uns das meist erst auf, wenn wir schlecht Luft bekommen. Wenn wir kurzatmig werden. Für Patientinnen und Patienten mit chronischen Lungenerkrankungen ist dieser Zustand Alltag. Sie leiden ein Leben lang unter Luftnot. Weit verbreitete Lungenerkrankungen sind Asthma und chronische Bronchitis. Es gibt aber auch einige seltene Erkrankungen, in denen die Lungenfunktion eingeschränkt ist. Beispielsweise bei Mukoviszidose (mehr zu diesem Thema erfahren Sie im Beitrag „Mukoviszidose – Beeinträchtigung der Lungen früh und gefahrlos erkennen“). Es gibt noch viele weitere seltene Lungenerkrankungen, bei denen beispielweise lebenswichtige Stoffe nicht gebildet werden, welche die Lunge normalerweise schützen. Die Folge ist immer die gleiche: Lebenswichtiges Lungengewebe wird zerstört und das Atmen fällt immer schwerer.
Die Ursachen für diese seltenen Erkrankungen sind oftmals bekannt: Es sind ganz bestimmte GenAbschnitte, die verändert sind und zur Folge haben, dass die Lungenfunktion mit der Zeit immer schlechter wird. Obwohl die Ursachen und Gen-Orte meist bekannt sind, können diese Krankheiten bislang nicht geheilt werden. Zurzeit zielt die Behandlung der Betroffenen vor allem darauf, die Beschwerden zu lindern und die Lungenfunktion so lange wie möglich aufrecht zu erhalten. Doch trotz immer besserer und effizienterer Behandlungsmethoden sterben viele Patientinnen und Patienten an Lungenversagen.
Ein Netzwerk für seltene Lungenerkrankungen
CARPuD steht für den englischen Ausdruck „Cellular Approaches for Rare Pulmonary Diseases“, übersetzt also „Zellbasierte Verfahren für seltene Lungenerkrankungen“. Ziel des Forschungsnetzwerks ist es, völlig neue Behandlungsmethoden für seltene Lungenerkrankungen zu entwickeln, die auf Zellersatz basieren. Das heißt, dass kranke Zellen durch gesunde patienteneigene Zellen ersetzt werden sollen.
Dieser Forschungsansatz wird dadurch möglich, dass vor einigen Jahren eine Methode entwickelt wurde, Stammzellen aus ganz gewöhnlichen Körperzellen herzustellen. Im Fachjargon spricht man von iPS-Zellen, den induzierten pluripotenten Stammzellen (mehr zum Thema iPS-Zellen lesen Sie im Beitrag „Erbliche Querschnittslähmung: Ein Schritt zur Verbesserung der Therapie“). Das Prinzip dahinter hört sich einfach an, ein erfolgreiches Ergebnis wird in der Praxis aber oft nur nach langwierigen Laborversuchen erreicht: Mittels einer Gewebeprobe wird eine ausgereifte Körperzelle gewonnen. Im Labor wird diese Zelle durch einen bestimmten Cocktail an Substanzen umprogrammiert zu einer Stammzelle, die sich jetzt wiederum in viele andere Körperzellen weiterentwickeln kann. Denkbar wären hierbei Nerven-, Leber- und Lungenzellen.
Die Forscherinnen und Forscher von CARPuD nutzen und erweitern diese Methode. Sie entnehmen den Erkrankten Blutzellen und programmieren diese im Labor zu Stammzellen um. Das veränderte Gen, das die seltene Lungenkrankheit auslöst, wird dann durch ein gesundes ersetzt. Die Stammzellen mit dem gesunden Gen müssen anschließend im Labor zu voll funktionstüchtigen Lungenzellen heranreifen, damit sie bei Patientinnen und Patienten die erkrankten Zellen ersetzen könnten. Wenn weitere Organe durch die Krankheit betroffen sind, müssen aus den Stammzellen auch entsprechende Zellen gezüchtet werden.
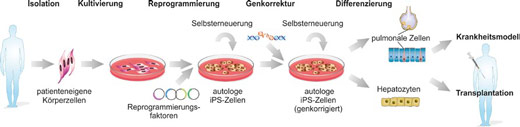
Die Grafik zeigt, wie ausgereifte Körperzellen zu gesunden Leberzellen (Hepatozyten) oder Lungenzellen (pulmonale Zellen) umprogrammiert
werden können. Besonders ist, dass es sich um autologe, also körpereigene und nicht körperfremde Zellen handelt. Auf diese Weise
kann eine Abstoßung der Zellen durch das Immunsystem des Patienten umgangen werden, da die Zellen nicht als „fremd“ erkannt werden.
Das Ziel: Ursache der Krankheiten beheben
„Die Forschung mit iPS-Zellen hat sich rasant weiterentwickelt“, erklärt Professor Ulrich Martin. Er leitet die Leibniz Forschungslaboratorien für Biotechnologie und künstliche Organe (LEBAO) an der Medizinischen Hochschule Hannover und koordiniert das CARPuD-Netzwerk. „Diese Zellen bieten nicht nur Möglichkeiten für Zelltherapien, sondern helfen uns auch bei der molekularen Ursachenforschung weiterer seltener Erkrankungen und der Wirkstoffforschung“, ergänzt er.
Ein großer Vorteil dieser Methode: Die bei Transplantation von körperfremdem Material üblichen Abstoßungsreaktionen des Empfängers werden umgangen, weil patienteneigene Zellen verwendet werden. Doch wann diese Behandlung möglicherweise das erste Mal in der Klinik eingesetzt werden kann, können die Forscherinnen und Forscher zurzeit noch nicht vorhersagen. „Das dauert bestimmt noch einige Jahre. Alle Untersuchungen befinden sich zurzeit im experimentellen Stadium“, betont Martin. „Was uns treibt ist die Aussicht darauf, erstmalig tatsächlich die Ursache einer bisher nicht oder nur unzureichend behandelbaren Lungenerkrankung zu beseitigen“, resümiert Martin. Er spricht hier für alle beteiligten Forscherinnen und Forscher.
Das CARPuD-Netzwerk wird seit 2012 neben anderen Netzwerken für seltene Erkrankungen bereits zum zweiten Mal für drei Jahre mit über einer Million Euro vom Bundesministerium für Bildung und Forschung (BMBF) gefördert. Die beteiligten Forscher arbeiten eng mit dem Deutschen Zentrum für Lungenforschung (DZL) und dem Exzellenzcluster REBIRTH zusammen.
Ansprechpartner:
Prof. Dr. Ulrich Martin
Leibniz Forschungslaboratorien für Biotechnologie und künstliche Organe (LEBAO)
Medizinische Hochschule Hannover
Carl-Neuberg-Straße 1
30625 Hannover
Tel.: 0511 532-8820
Fax: 0511 532-8819
E-Mail: martin.ulrich@mh-hannover.de