Forschende des Deutschen Zentrums für Diabetesforschung (DZD) haben die 3-D-Struktur des Insulin-Rezeptors entschlüsselt und was genau passiert, wenn Insulin daran bindet. Das ist wichtig, um effektivere Insuline entwickeln zu können.

Typ-1-Diabetes ist die häufigste Stoffwechselerkrankung im Kindes- und Jugendalter. Ursache ist eine Autoimmunreaktion: Die Abwehrzellen des Immunsystems greifen die Insulin produzierenden Betazellen in der Bauchspeicheldrüse an und zerstören sie. Versiegt die körpereigene Produktion, muss das Hormon zeitlebens von außen zugeführt werden. Das lebenswichtige Hormon reguliert den Blutzuckerspiegel. Es wirkt wie ein Schlüssel, der ein Schloss an der Zelle (Insulinrezeptor) aufschließt, damit der Zucker (Glukose) aus dem Blut in die Zellen gelangt.
„Als in den 1920er-Jahren zum ersten Mal Patienten Insulin verabreicht wurde, war dies ein echter Durchbruch in der Diabetesbehandlung. Es ist jedoch nach wie vor eine Herausforderung, Insuline zu generieren, die über das gesamte Wirkspektrum eines körpereigenen Insulins verfügen“, erklärt Dr. Ünal Coskun, Leiter der Forschungsgruppe Membranbiochemie am Paul Langerhans Institut des Helmholtz Zentrums München, einem Partner des Deutschen Zentrums für Diabetesforschung (DZD). Das Institut ist angegliedert an das Universitätsklinikum Carl Gustav Carus und an die Medizinische Fakultät Carl Gustav Carus der Technischen Universität Dresden.
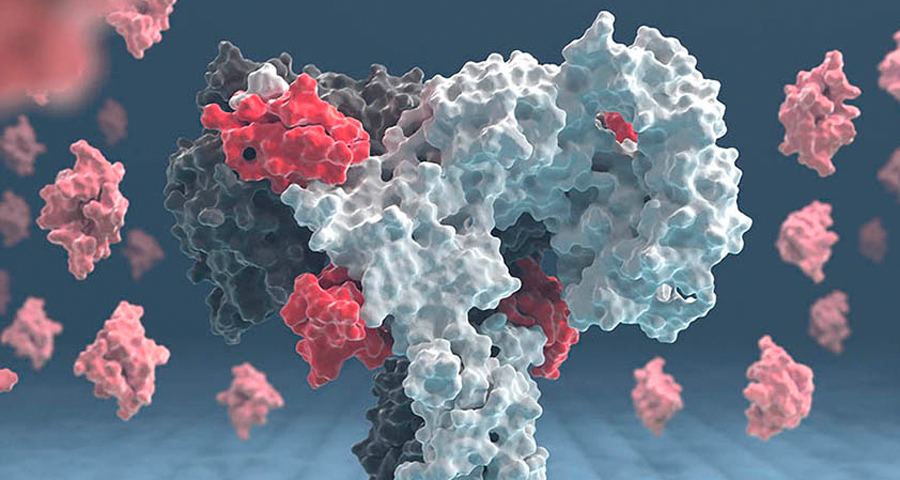
Grafisch aufbereitetes Modell des Insulinrezeptors mit gebundenen Insulinmolekülen (rot).
Jyrki Hokkanen (CSC – IT Center for Science Ltd., Finnland)
Um effektivere Insuline entwickeln zu können, ist ein möglichst genaues Verständnis über das Zusammenspiel des Hormons mit seinem Rezeptor wichtig. Bereits vor 40 Jahren wurde erstmals vermutet, dass Insulin an zwei verschiedenen Stellen am Rezeptor bindet. Obwohl mittlerweile viel über die Wechselwirkungen bekannt ist, die an der ersten dieser Bindestellen auftreten, wusste man nur sehr wenig darüber, was an der zweiten Stelle passiert. „Doch erst das genaue Verständnis, wie Insulin mit seinem Rezeptor an beiden Bindestellen interagiert, erlaubt es den Forschenden, verbesserte Wirkstoffe für insulinbedingte Erkrankungen zu entwickeln“, betont Coskun.
Rezeptor kann vier Moleküle binden
In einer neuen Studie hat sein Team gemeinsam mit Kolleginnen und Kollegen des Max-Planck-Instituts für Biochemie in Martinsried, der McGill University in Kanada und der Universität Helsinki in Finnland nun ein wichtiges Teil des Puzzles gefunden. Die Forschenden konnten erstmals sichtbar machen, dass der Rezeptor aus zwei identischen Teilen besteht, die jeweils zwei Insulinbindungsstellen enthalten. An einen Rezeptor können also vier Insulinmoleküle binden. Mit der leistungsstarken Technik der Kryoelektronenmikroskopie, die molekulare Strukturen sichtbar machen kann, haben die Forschenden ein detailliertes 3-D-Bild des äußeren Teils (Ektodomäne) des Insulinrezeptors inklusive gebundenem Insulin erstellen können. Mit diesem Verfahren gelang es den Forschenden erstmals, direkt die Bindung von Insulin an der zweiten Bindungsstelle zu beobachten und zu zeigen, wie der Insulinrezeptor seine Struktur verändert. Vorherige Untersuchungen der Forschenden aus Dresden und der Rockefeller University in den USA aus dem Jahr 2018 hatten bereits gezeigt, dass sich die Struktur des Insulinrezeptors von einem umgekehrten „U“ in eine „T“-förmige Struktur ändert, wenn Insulin an den Rezeptor bindet.
„Wir haben die Ektodomäne des Insulinrezeptors untersucht, nachdem sie mit hohen Insulinkonzentrationen gesättigt wurde“, erklärt die Mitautorin der Studie, Dr. Theresia Gutmann vom Paul Langerhans Institut. Die Forschenden haben mehr als 8.000 elektronenmikroskopische Bilder aufgenommen und mehr als 300.000 einzelne Rezeptorpartikel analysiert. So gelang es ihnen, den Insulinrezeptor in seiner vollen Länge abzubilden.
Computergestützte Modellierungs- und Simulationsmethoden
Parallel dazu nutzten die Wissenschaftlerinnen und Wissenschaftler computergestützte Modellierungs- und Simulationsmethoden, um die Wechselwirkungen von Insulin und Rezeptor auf atomarer Ebene zu verstehen. Solche Computertechniken werden immer wichtiger, um komplizierte dynamische Prozesse in lebenden Zellen zu analysieren. Sie bieten zudem den zusätzlichen Vorteil, dass Wirkstoffscreenings am Computer durchgeführt werden können.
Entwicklung effektiverer Insuline möglich
Die neuen Erkenntnisse sind für Grundlagenforschende und Erkrankte gleichermaßen interessant. „Die Details zu den Interaktionen zwischen Insulin und seinem Rezeptor können nicht nur die aktuellen Modelle der Insulinbindung an seinen Rezeptor erweitern, sondern auch die Grundlage für neue Ansätze zu einem strukturbasierten Medikamentendesign für insulinbedingte Krankheiten bilden“, fasst Coskun zusammen. Damit die Betroffenen möglichst schnell von neuen Erkenntnissen profitieren können, sind die Daten für alle – Forschende und Pharmafirmen – im Internet zugänglich.
DZD – Forschen für eine Zukunft ohne Diabetes
Im Deutschen Zentrum für Diabetesforschung (DZD) arbeiten Expertinnen und Experten aus Grundlagenforschung, Epidemiologie und klinischer Anwendung deutschlandweit zusammen. Durch diesen translationalen Forschungsansatz können Beobachtungen aus epidemiologischen Studien im Labor überprüft und die Ergebnisse aus dem Labor schneller in die klinische Anwendung überführt werden. Ziel des DZD ist es, die Erkenntnisse der Diabetesforschung möglichst schnell zum Erkrankten zu bringen, um Diabetes vorzubeugen und zu behandeln sowie Folgeerkrankungen zu vermeiden. Das DZD wird vom Bundesministerium für Bildung und Forschung (BMBF) gemeinsam mit den fünf Sitzländern gefördert.
Originalpublikationen:
Gutmann T, Schäfer IB, Poojari C, et al.: Cryo-EM structure of the complete and ligand-saturated insulin receptor ectodomain. Journal of Cell Biology, 2020 Jan 6; 219(1) doi: 10.1083/jcb.201907210.
Gutmann T, Kim KH, Grzybek M, Waltz T, Coskun Ü: Visualization of ligand-induced transmembrane signaling in the full-length human insulin receptor. Journal of Cell Biology, 2018 May 7; 217(5):1643-1649. doi: 10.1083/jcb.201711047.
Fachliche Ansprechpersonen:
Dr. rer. nat. Ünal Coskun
Dr. rer. nat. Theresia Gutmann
Paul Langerhans Institut Dresden des Helmholtz Zentrums München am Universitätsklinikum und der Medizinischen Fakultät Carl Gustav Carus der TU Dresden
Fetscherstraße 74
01307 Dresden
uenal.coskun@helmholtz-muenchen.de
Pressekontakt:
Birgit Niesing
Deutsches Zentrum für Diabetesforschung (DZD)
Ingolstädter Landstraße 1
85764 Neuherberg
niesing@dzd-ev.de