Trojanische Pferde gelangen als vermeintliche Geschenke hinter feindliche Verteidigungswälle. Dort entfalten sie ihre tödliche Wirkung. Dieses Prinzip machen sich Forschende zunutze, um neue Wirkstoffe gegen bakterielle Infektionen zu entwickeln.

Bakterien benötigen Eisen für ihren Stoffwechsel. Sie senden deshalb spezielle Moleküle aus, um Eisenionen einzufangen und in ihre Zellen zu schleusen. Die neuen Wirkstoffe imitieren diese Moleküle. Wie Trojanische Pferde gelangen sie auf dem Eisen-Transportweg in Bakterienzellen, wo sie Infektionen nachweisen und behandeln können.
peterschreiber.media/Adobe Stock
Immer mehr bakterielle Krankheitserreger entwickeln Resistenzen gegenüber Antibiotika – das ist zu einer globalen Herausforderung geworden. Weltweit sterben aktuellen Studien zufolge rund 1,3 Millionen Menschen jährlich an Infektionen, die nicht mit den gängigen antibiotischen Wirkstoffen bekämpft werden können. Eine besondere Bedrohung geht dabei von der Gruppe der sogenannten gramnegativen Bakterien aus, denn diese verfügen über eine zweite Zellmembran, die sie vor der Anreicherung von antibiotisch wirksamen Molekülen schützt. Dementsprechend handelt es sich bei vielen Krankheitserregern, die auf einer von der Weltgesundheitsorganisation (WHO) erstellten Prioritätenliste als „kritisch“ eingestuft wurden, um arzneimittelresistente gramnegative Arten. Besonders häufig sind diese resistenten Erreger in Krankenhäusern und anderen Einrichtungen des Gesundheitswesens zu finden.
Verbund SCAN
Im Verbund SCAN (Siderophore Conjugates Against gram-Negatives) arbeiteten Forschende aus Deutschland, Frankreich und Israel zusammen. Er wird von 2019 bis 2022 im Rahmen der „Joint Programming Initiative on Antimicrobial Resistance“ (JPIAMR) mit rund 500.000 Euro vom Bundesministerium für Bildung und Forschung (BMBF) gefördert. JPIAMR ist eine internationale Kooperationsplattform, an der 29 Nationen und die Europäische Kommission beteiligt sind, um unter anderem durch gemeinsame, transnationale Förderinitiativen antimikrobielle Resistenzen weltweit einzudämmen.
Weitere Infos finden sich unter https://scanproject-siderophore.com/.
„Weltweit werden dringend neue und innovative Strategien zur Überwindung der Außenmembran der gramnegativen Bakterien benötigt“, sagt Professor Dr. Mark Brönstrup, Leiter der Abteilung „Chemische Biologie“ am Helmholtz-Zentrum für Infektionsforschung (HZI). „Auch haben wir großen Bedarf an einer schnellen Diagnose von aktiven bakteriellen Infektionen, insbesondere an der Oberfläche von Implantaten und an anderen schwer erreichbaren Körperstellen.“ Forschende in dem von Brönstrup koordinierten Projekt SCAN (Siderophore Conjugates Against gram-Negatives) haben nun ein neues Werkzeug entwickelt, das sowohl zur Diagnose als auch zur Behandlung bakterieller Infektionen eingesetzt werden kann.
Ausgenutzt: Die Gier der Krankheitserreger nach Eisen
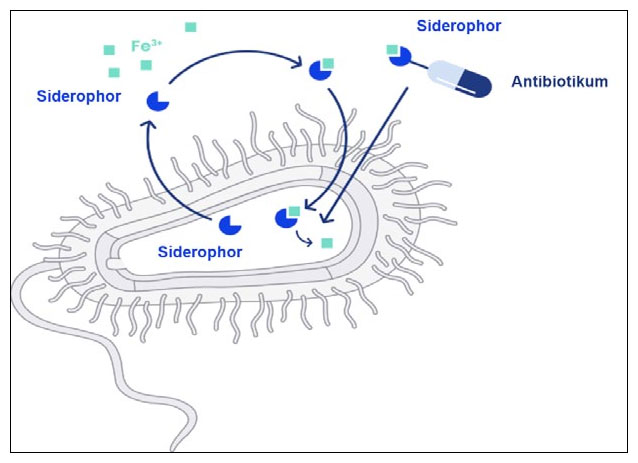
Antibiotika werden an Siderophore gebunden und zusammen mit Eisen in die Bakterien transportiert.
Helmholtz-Zentrum für Infektionsforschung (HZI)
Um an den knappen Nährstoff Eisen heranzukommen, produzieren Bakterien Siderophore − kleine Moleküle, die in der Lage sind, Eisen in der Umgebung abzufangen und es in die Bakterienzellen zu transportieren. „Unsere Wirkstoffe machen sich den bakteriellen Eisenbedarf zunutze“, so Brönstrup. „Sie bestehen aus einem künstlichen Siderophor, das an ein vielversprechendes Antibiotikum gebunden wird. Über seinen Eisentransporter nimmt das Bakterium diesen antibiotischen Eisen-Siderophor-Komplex auf. Der Erreger schleust sich somit seinen eigenen Tod ins Innere.“
Aktive Infektionen leuchten wie ein Glühwürmchen
Doch die Siderophore aus dem Labor können noch mehr: Um das Vorliegen von Infektionen schnell und zuverlässig nachweisen zu können, haben die Forschenden die neuen Verbindungen mit einer Art „molekularem Lichtschalter“ ausgestattet. Dafür koppelten die Wissenschaftlerinnen und Wissenschaftler ein Molekül der Gruppe der Dioxetane an die Siderophore. Mit Dioxetanen verwandte Moleküle sind auch in Glühwürmchen zu finden und in diesen für das charakteristische Leuchten verantwortlich. Wenn Bakterien aus einer Gruppe von zunächst sechs im Rahmen der Forschungsarbeiten untersuchten Spezies die Sonden in ihrem Zellinneren enzymatisch spalten, wird der Lichtschalter betätigt und die Probe leuchtet.
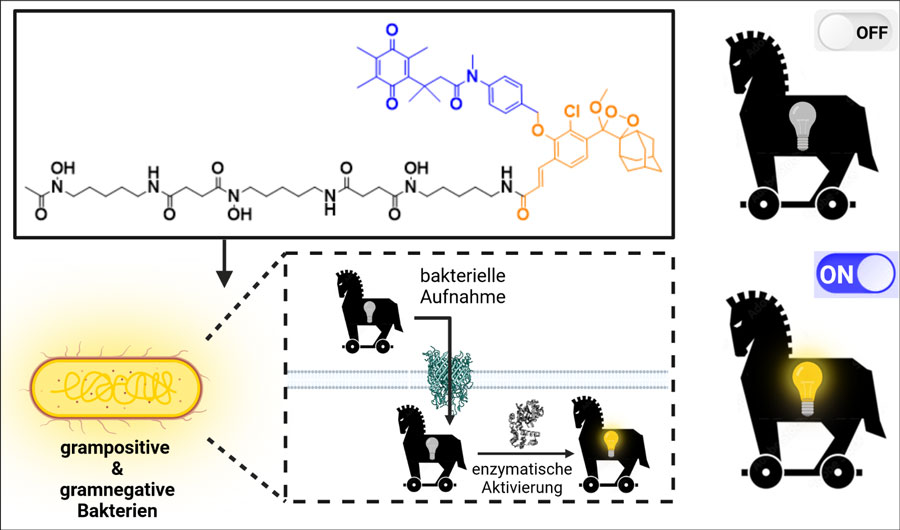
Farbstoffe aus der Gruppe der Dioxetane (orange) werden an Siderophore (schwarz) gebunden und zusammen mit Eisen in die Bakterien transportiert. Bakterieneigene Enzyme aktivieren den Schalter (blau), was zum Leuchten des Dioxetans führt.
Helmholtz-Zentrum für Infektionsforschung (HZI)
Es gibt bereits andere molekulare Diagnostikmethoden wie die Massenspektrometrie oder die Polymerase-Kettenreaktion. Ihr Nachteil: Sie unterscheiden nicht zwischen toten und lebenden bakteriellen Zellen. „Unsere Methode bietet den Vorteil, dass nur lebende Bakterien nachgewiesen werden. Wenn die Sonden aufleuchten, liegt also vermutlich eine aktive Infektion vor“, sagt Carsten Peukert, Doktorand und Erstautor einer aktuellen Publikation zur Studie. „Für die Zukunft erwarten wir, dass wir beide Funktionen in einem Molekül zu einem sogenannten Theranostikum vereinen können. Die neuen Siderophor-basierten Antibiotika und Diagnostika sind vielversprechende Ansätze zur wirksamen Behandlung und Überwachung bakterieller Infektionen. Damit leisten sie auch einen Beitrag zur Prioritätenliste der WHO zur Erforschung und Entwicklung neuer Antibiotika.“
Antibiotika und Resistenzen
Bakterien verfügen über die Fähigkeit, sich gegen Antibiotika zu schützen, die von anderen Mikroorganismen produziert werden. Daher kommen Antibiotikaresistenzen ganz natürlich in der Umwelt vor. Sie entstehen durch Mutationen im Erbgut der Bakterien, die zur Ausbildung sogenannter Resistenzgene führen. Werden Antibiotika zu oft, über einen zu langen Zeitraum oder unsachgemäß eingesetzt, begünstigt das die Entstehung und Verbreitung von resistenten Erregern. Es überleben die Bakterienstämme, die eine natürliche Resistenz gegenüber dem Antibiotikum besitzen; sie können sich vermehren und weiter ausbreiten. Bakterien können Resistenzgene auch untereinander austauschen und zudem mehrere Resistenzgene aufnehmen, die sie gegen verschiedene Antibiotika schützen. So entstehen mehrfach- bzw. multiresistente Erreger (MRE), die einer Vielzahl von Antibiotika widerstehen können.
Originalpublikationen:
Peukert, C., Popat Gholap, S., Green, O., et al. (2022). Enzyme-activated, Chemiluminescent Siderophore-Dioxetane Probes Enable the Selective and Highly Sensitive Detection of Bacterial ESKAPE Pathogens. Angew Chem Int Ed Engl. 2022 Jun 20;61(25): e202201423. DOI: 10.1002/anie.202201423
Pinkert, L., Lai, Y.-H., Peukert, C., et al. (2021). Antibiotic Conjugates with an Artificial MECAM-Based Siderophore Are Potent Agents against Gram-Positive and Gram-Negative Bacterial Pathogens. J Med Chem. 2021 Oct 28;64(20):15440–15460. DOI: 10.1021/acs.jmedchem.1c01482
Ansprechpartner:
Prof. Dr. Mark Brönstrup
Helmholtz-Zentrum für Infektionsforschung
Abteilungsleiter Chemische Biologie
Inhoffenstraße 7
38124 Braunschweig
0531 6181-3400
mark.broenstrup@helmholtz-hzi.de