Klinische Studien umfassen verschiedene Phasen: Erst nachdem Verträglichkeit und Wirkungsweise neuer Methoden an gesunden Freiwilligen erforscht wurden, wird die Wirksamkeit der neuen Behandlung auch an erkrankten Personen untersucht.
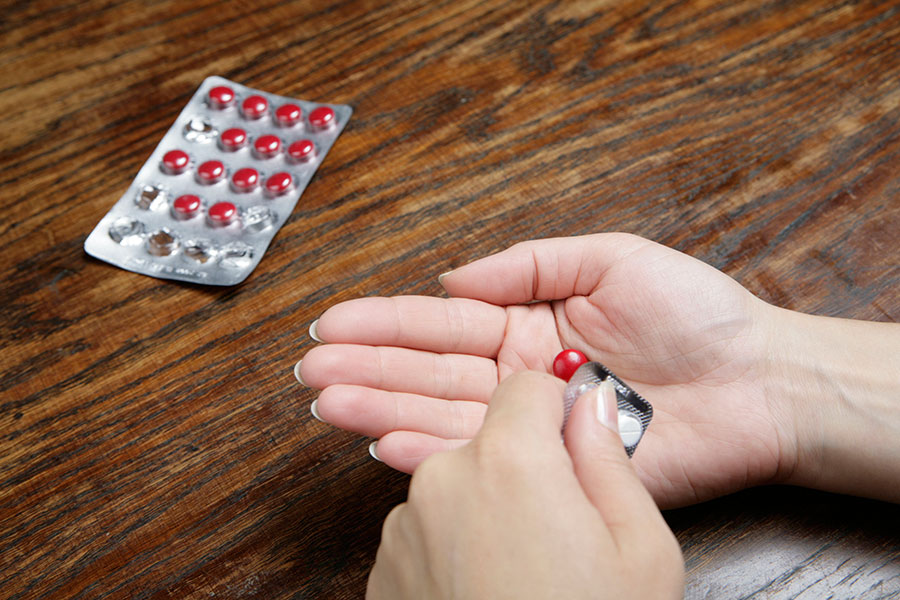
Die an verblindeten Studien Teilnehmenden wissen nicht, ob sie tatsächlich einen neuen Wirkstoff oder ein Placebo erhalten. Das schließt Verfälschungen der Ergebnisse durch Suggestionseffekte aus.
DLR Projektträger / BMBF
Grundsätzlich sind zwei Studientypen zu unterscheiden: Erfahren die Teilnehmenden eine aktive Form von Behandlung, spricht man von interventionellen Studien. Eine Intervention ist eine Maßnahme, die den Ausbruch oder das Fortschreiten einer Erkrankung verhindern soll. Das kann beispielsweise die Einnahme eines neuen Arzneimittels sein. Beobachtungsstudien ohne jegliches Eingreifen werden dagegen nicht-interventionelle Studien genannt.
Interventionelle Studien
Diese Studien sind in der Regel Therapiestudien, bei denen eine neue Behandlungsmethode erprobt wird. Interventionelle (Arzneimittel-)Studien werden in vier Phasen eingeteilt.
Nicht-interventionelle Studien
Bei den nicht-interventionellen Studien, auch Beobachtungsstudien genannt, findet keine gezielte Intervention statt. Es wird lediglich beobachtet und dokumentiert. Es gibt drei wichtige Studientypen:
Kontrollierte Interventionsstudien vergleichen die neue Behandlung mit einer anderen Behandlung oder mit einer Scheinbehandlung, einem Placebo. Dieser Vergleich ist wichtig, um den tatsächlichen Effekt einer Behandlung zuverlässig beurteilen zu können.
Randomisierung bedeutet, dass die Teilnehmenden den verschiedenen Studiengruppen per Zufallslos zugeteilt werden. Die Gruppe, die die neue Behandlung erhält, wird „Verumgruppe“ oder „Behandlungsgruppe“ genannt. Die Gruppe, die eine andere Behandlung oder ein Placebo erhält, ist die „Kontrollgruppe“. Ist die Studie groß genug, dann gewährleistet die Zufallsverteilung, dass die Patientinnen und Patienten in beiden Gruppen ähnliche Eigenschaften haben. Nur dann sind die Ergebnisse miteinander vergleichbar und aussagekräftig.
Verblindung bedeutet, dass die Patientinnen und Patienten nicht wissen, ob sie in der Verumgruppe oder in der Kontrollgruppe sind. Bei einer doppelten Verblindung weiß das auch die ärztliche Seite nicht. Eine Verblindung verhindert, dass Erwartungen und Suggestionseffekte die Ergebnisse klinischer Studien verfälschen.